九州网页版“双学分”课程相关材料
(蛋白质工程)
《蛋白质工程》课程简介
蛋白质是所有生命体的重要组成部分,是一切生命的物质基础,生命体的一
切代谢活动都与蛋白质的活动和代谢密切相关,从最简单的病毒到最复杂的人体, 哪里有生命,哪里就存在着蛋白质,蛋白质存在于生物体的各种不同部位,行使
着生命过程中的各种重要机能,在催化生命体内的各种生化反应、代谢调节、抵御外来物质入侵及控制遗传信息等方面起着至关重要的作用。如果说 DNA 是遗传信息的携带者和生命的指导者,那么蛋白质就是生命的执行者。
蛋白质工程是指通过对蛋白质进行修饰,改造和拼接以生产出能满足人类需要的新型蛋白质的技术,是现代生物工程技术的重要内容。蛋白质工程是在基因重组技术、生物化学、分子生物学、分子遗传学等学科的基础之上,融合了蛋白质化学、结构生物学、生物物理学、生物信息学和计算机辅助设计等多学科而发展起来的新兴研究领域,也是一种综合性生物工程技术。蛋白质工程包括蛋白质的分离纯化、蛋白质结构和功能的分析、设计和预测,通过物理、化学、生物和基因重组等技术改造蛋白质或设计合成具有特定功能的新蛋白质,将蛋白质的研究推进到崭新的时代,在制药、化工、农业和环保等领域都有广阔的应用前景。
《蛋白质工程》课程已经成为高校生物技术和生物工程类专业以及生物制药专业的一门重要专业课程。蛋白质工程应用领域的快速发展决定了《蛋白质工程》是一门综合性很强,对基础知识要求高,且内容繁杂,并不断发展的课程,教学难度较大。
培养创新人才已经成为新一轮高校改革的重要内容,根据社会需求,培养具备能够运用知识创造性地解决问题的能力和发现新知识的能力的创新型人才是我们的宗旨。蛋白质工程应用领域的飞速发展导致技术革新加快,新发明、新应用层出不穷,要解决各种新出现的实际问题,要求学生不仅要掌握书本上的理论知识,还要掌握蛋白质工程技术的核心思想,并具有创新精神。
《蛋白质工程》课程内容包括蛋白质工程的基本原理,蛋白质的结构与理化
性质,工业蛋白质及其应用,蛋白质组织工程,固定化酶技术,蛋白质结晶,蛋白质分子设计,荧光蛋白,蛋白质芯片,蛋白质分子印迹技术及蛋白质生物传感器等。
通过本课程的学习,使学生掌握蛋白质工程的基本理论、基础知识、主要研究方法和技术以及生物信息学和现代生物技术在蛋白质工程上的应用及典型研究实例,熟悉从事蛋白质工程的重要方法和途径。努力培养学生具有科学思维方式、启发学生科学思维能力和勇于探索,善于思考、分析问题的能力,激发学生的学习热情。通过学习本课程,使学生掌握蛋白质工程科学的基本原理、基础知识、基本技能,熟悉从事蛋白质科学与工程研究的主要方法和技术,为日后从事蛋白质科学以及相关生命科学领域的科学研究与生产实践打下理论基础。
九州网页版制药工程学院为生物制药专业本科生设置蛋白质工程课程,该课程可使学生将之前所学的众多理论知识融会贯通,并在实践中加以应用,包括在 CDIO3 中的具体实践操作,对培养具有从事蛋白质研究及生产的技术人才有很大的帮助。
《蛋白质工程》课程教学大纲
英文名称: Protein Engineering 课程号:1200061340 学时:36 学分:2
课程类别:学科专业平台课课程性质:专业选修课
课程归属单位:制药工程学院适用专业:生物制药编制时间:2016 年 8 月
一、 课程的简介
蛋白质工程是生物制药专业一门基础的专业课程。要求学生掌握蛋白质工程的概念,基本理论,基础知识、主要研究方法和技术,以及现代生物技术在蛋白质工程上的应用及典型研究实例;熟悉从事蛋白质工程的重要方法和途径;了解相关领域的最新研究成果及科研动向;为培养专业素质打下坚实的基础。
通过学习,学生应该可以达到以下目标: 知识目标
(1) 掌握蛋白质工程的基本概念、研究内容;
(2) 掌握蛋白质各个结构层次的组成、基本特点与功能等;
(3) 掌握工业蛋白质的种类及应用;
(4) 熟悉工业蛋白质的种类与功能特性及工业蛋白质的改性方法;
(5) 掌握蛋白质分子的现代应用技术,包括蛋白质印迹等;
(6) 掌握蛋白质工程的技术应用,蛋白质芯片、蛋白质生物传感器;
(7) 掌握蛋白质分子设计技术;
(8) 掌握蛋白质的抗体酶工程技术和酶的固定化技术;
(9) 熟悉蛋白质的分析方法;
(10) 学习蛋白质工程领域文献查阅方法。
能力目标:
(1) 具备基本的实验设计和结果分析能力
(2) 具备简单的蛋白质分子设计的能力;
(3) 具备分析蛋白质基本理化性质的能力;
(4) 具备使用网络技术,搜集、分析、判断、选择蛋白质工程研究领域研究热点的能力;
(5) 具有一定的文献综述能力
(6) 具备整合思维能力和有效的交流能力。
蛋白质工程是一个新兴的技术领域,是生物工程的重要组成部分。其特点是以蛋白质的结构功能的关系为基础,通过基因修饰或基因合成等手段,对现有蛋白质加以定向改造,或对所需蛋白质进行全新设计,构建并最终生产出性能比自然界现存蛋白质更加优越、更加符合人类社会需要的新型蛋白质。
蛋白质是生命的体现者,离开了蛋白质,生命将不复存在。蛋白质是构成组织细胞的主要材料,人的大脑、神经、皮肤、肌肉、内脏、血液,甚至指甲、头发都是以蛋白质为主要成分构成的。蛋白质的功能是构成组织与修补组织,这充分体现了蛋白质的重要性.蛋白质在生物界与非生物界的信息交流中起着关键的作用。
目前,蛋白质工程尚未有统一的定义。一般认为蛋白质工程就是通过基因重组技术改变或设计合成具有特定生物功能的蛋白质。因此,有学者称,蛋白质工程是第二代基因工程。其基本实施目标是运用基因工程的 DNA 重组技术,将克隆后的基因编码加以改造,或者人工组装成新的基因,再将上述基因通过载体引入挑选的宿主系统内进行表达,从而产生符合人类设计需要的“突变型”蛋白质分子。这种蛋白质分子只表达人类需要的性状。
实际上,蛋白质可以是一种营养品、一种致病源物质、一种治病良药、一种生产材料。它们各具有不同的结构和功能,应用于社会生产的不同方面。可是, 生物体内存在的天然蛋白质,往往在不同领域的应用上不尽如人意,需要进行改造。由于蛋白质是由许多氨基酸按一定顺序连接而成的,每一种蛋白质有自己独特的氨基酸顺序,改变其中关键的氨基酸就能改变蛋白质的性质。由于蛋白质是两性电解质,每一种蛋白质有自己独特的 pH 和等电点,因此改变其中关键的氨基酸就能改变蛋白质所带电荷特性,进而改变蛋白质的性质。
从广义上来说,蛋白质工程应是以蛋白质为原材料,进行生产性为主的、建设性的、对蛋白质进行合理利用的过程。在这个过程中人们需要改造蛋白质,对蛋白质进行修饰与加工,通过物理、化学、生物,如基因重组等技术改造蛋白质或设计合成具有特定功能的新蛋白质。
蛋白质工程是随着生物化学、分子生物学、结构生物学、晶体学和计算机技术等的迅猛发展而诞生的,也与基因组学、蛋白质组学、生物信息学等的发展密切相关,是融合了蛋白质晶体学、蛋白质动力学、蛋白质化学和计算机辅助设计等多学科而发展起来的新兴研究领域。由于蛋白质工程学科的边缘性,所以本课程在介绍蛋白质基本内容的同时,兼顾学科发展动向,旨在使学生了解现代蛋白质工程理论的新进展并为相关学科提供知识和技术。
通过本课程的学习,使学生掌握蛋白质工程的基本理论、基础知识、主要研究方法和技术以及生物信息学和现代生物技术在蛋白质工程上的应用及典型研究实例,熟悉从事蛋白质工程的重要方法和途径。努力培养学生具有科学思维方式、启发学生科学思维能力和勇于探索,善于思考、分析问题的能力,激发学生的学习热情。通过学习本课程,使学生掌握蛋白质工程科学的基本原理、基础知识、基本技能,熟悉从事蛋白质科学与工程研究的主要方法和技术,为日后从事蛋白质科学以及相关生命科学领域的科学研究与生产实践打下理论基础。
二、 主要教学环节及学时安排
教学环节 |
理论教学 |
实验 |
合计 |
学时数 |
26 |
10 |
36 |
注:①教学环节仅供参考,请根据培养方案自行修改;②理论教学的学时数是指安排在教室授课的学时;实验课的学时是必须在实验课表上体现;实践指导为无固定时间和固定地点,指导方式由教师灵活把握。
三、 先修要求
生物化学、分子生物学、细胞生物学、基因工程、生物信息学
四、 预期学习成果
教学内容 |
预期学习成果 |
要求程度 |
一级标题 |
学 时 |
二级标题 |
知识 |
能力 |
蛋白质工程的基本理论 |
1 |
蛋白质工程的内涵 |
理解广义蛋白质工程的概念 |
能说出蛋白质工程的概念 |
L2 |
理解狭义蛋白质工程的概念 |
|
L2 |
蛋白质工程的功能与研究内容 |
了解蛋白质工程的功能 |
|
L1 |
了解蛋白质工程的研究内容 |
|
L1 |
蛋白质工程的产生与发展 |
了解蛋白质工程的产生 |
|
L1 |
了解蛋白质工程的发展 |
|
L1 |
蛋白质工程的主要成就 |
了解蛋白质工程的应用领域 |
能举例说出蛋白质工程的应用领域 |
L1 |
蛋白质的结构 |
2 |
蛋白质的初级结构 |
掌握蛋白质的元素组成及特点 |
能说出组成蛋白质的基本 元素 |
L3 |
掌握氨基酸的结构通式 |
能写出氨基酸的结构通式 |
L3 |
掌握氨基酸的分类方法 |
能判断给出氨基酸的类别 |
L3 |
了解几种特殊的氨基酸 |
|
L1 |
掌握肽键的定义及形成 |
能写出肽键的形成过程 |
L3 |
掌握肽单位的概念 |
能说出肽单位的概念 |
L3 |
掌握蛋白质一级结构的定义及 特点 |
能判断蛋白质一级结构的 类型 |
L3 |
蛋白质的高级结构 |
掌握蛋白质二级结构的定义及主要形式 |
能分辨蛋白质二级结构的类型 |
L3 |
了解超二级结构的概念及形成 |
|
L1 |
|
|
|
掌握结构域的概念 |
能说出结构域的概念 |
L3 |
理解蛋白质的三级结构 |
能判断蛋白质的三级结构 |
L2 |
理解蛋白质的四级结构 |
能比较蛋白质各级结构的 特点 |
L2 |
了解蛋白质的高级结构与初级 结构的关系 |
|
L1 |
工业蛋白质的种类与功能特性 |
1 |
工业蛋白质的定义 |
了解工业蛋白质的发展史 |
|
L1 |
掌握工业蛋白质的定义 |
能判断属于工业蛋白质 |
L2 |
工业蛋白质的种类 |
了解植物蛋白质的种类 |
|
L1 |
了解动物蛋白质的种类 |
|
L1 |
工业蛋白质的理化特性 |
掌握溶解性、水合能力的概念 |
能举例说明蛋白质的溶解 性和水合能力 |
L2 |
理解乳化性、起泡、黏度和凝 胶性 |
能举例说明蛋白质的乳化 性及 |
L2 |
了解组织形成性和风味结合性 |
|
L1 |
工业蛋白质的生产特性与要求 |
掌握工业蛋白质的生产特性 |
能够说出工业蛋白质的生 产特性 |
L2 |
理解特殊形成、决定的影响因 素 |
能判断影响因素 |
L2 |
了解一些工业蛋白质的物理化 学要求 |
|
L1 |
理解蛋白质结构与功能的关系 |
|
L1 |
工业蛋白质改性加工方法与利用途径 |
1 |
蛋白质改性的原理与目的 |
掌握蛋白质改性的原理与目的 |
能够说出蛋白质改性的原 理和目的 |
L3 |
蛋白质改性的途径与方法 |
掌握蛋白质改性的途径与方法 |
能够举例说明蛋白质改性 的途径 |
L3 |
|
|
改性的限制因素 |
了解蛋白质改性的限制因素 |
|
L1 |
蛋白质改性的方法 |
理解蛋白质改性的方法 |
能够举例说明蛋白质改性 的方法 |
L1 |
改性蛋白质的利用途径 |
了解蛋白质改性的应用 |
|
L1 |
蛋白质组织工程 |
2 |
天然蛋白基水凝胶 |
掌握水凝胶的概念 |
能够说出水凝胶的概念,并 且举例 |
L3 |
掌握天然蛋白基水凝胶的形成原理、作用与影响因素 |
能够说出天然蛋白基水凝 胶的形成原理、作用与影响因素 |
L3 |
掌握蛋白基水凝胶的类型 |
能够说出蛋白基水凝胶的 类型 |
L2 |
生物功能表面材料 |
理解生物功能表面材料的概念 |
|
L2 |
了解生物功能表面材料与蛋白质之间的关系 |
|
L1 |
骨组织工程的蛋白质支架材料 |
掌握支架的功能与作用 |
能够说出细胞支架的功能 与作用 |
L3 |
理解骨组织工程要素与支架材 料条件 |
能够举例说出组织工程的 要素和一些支架材料 |
L2 |
了解支架材料的种类 |
|
L1 |
理解支架的性能评价 |
|
L1 |
不同蛋白质制备组织工程支架 |
了解羊毛角蛋白做组织工程支 架材料的方法 |
|
L1 |
了解其他蛋白质做组织工程支 架的制备方法 |
|
L1 |
纳米纤维复合支架 |
理解纳米纤维的生物学效应 |
|
L2 |
了解纳米蛋白纤维的种类 |
|
L1 |
|
|
|
了解纳米纤维支架的构建方法 |
|
L1 |
了解复合支架的制备 |
|
L1 |
蛋白抗体酶工程技术 |
2 |
抗体酶工程的基本理论 |
了解抗体多样性及来源 |
|
L1 |
掌握抗体酶的产生 |
|
L3 |
掌握抗体酶的优点 |
能根据所学知识比较抗体酶与天然酶的区别 |
L3 |
产生抗体酶的原理与方法 |
掌握抗体酶产生的原理和方法 |
|
L3 |
用于产生抗体酶的抗体库技术 |
掌握PCR 引物克隆产生抗体酶 技术 |
|
L3 |
理解生物合成反应法产生抗体酶技术 |
|
L2 |
了解直接筛选法产生抗体酶技 术 |
|
L1 |
抗体酶活性部位的修饰 |
掌握定点突变法和化学法修饰抗体酶的活性部位 |
能分辨抗体酶活性部位的修饰方法 |
L3 |
抗体酶的晶体结构 |
了解三种抗体酶的晶体结构 |
能判断三种抗体酶的晶体 结构 |
L1 |
抗体酶研究新方法 |
理解抗体酶研究的新方法 |
能说出抗体酶研究的新方 法 |
L2 |
酶的固定化技术 |
3 |
酶的固定化技术概述 |
了解固定化酶的发展史 |
|
L1 |
了解固定化酶发展的动因和过 程 |
|
L1 |
掌握酶固定化的定义 |
能区分酶固定化与固定化酶的不同 |
L4 |
理解酶固定化技术的重要性 |
|
L2 |
掌握固定化酶的优缺点 |
能说出固定化酶的特点 |
L4 |
|
|
酶固定化的机制 |
掌握酶分子与载体连接的功能 基团的种类 |
能找到酶分子与载体连接 的功能基团 |
L4 |
理解固定化载体的选择 |
|
L2 |
理解偶联反应 |
|
L2 |
酶固定化的方法 |
掌握固定化方法的分类 |
能说出固定化方法的种类 |
L3 |
掌握物理固定方法的内容 |
|
L3 |
掌握化学固定方法的操作 |
能设计化学方法固定酶 |
L4 |
理解各种固定化酶特点的比较 |
|
L2 |
固定化酶载体材料与反应器 |
掌握载体的分类及对载体的要 求 |
能选择合适的载体用于固 定化酶 |
L4 |
理解合适的固定化条件 |
|
L2 |
了解固定化酶的反应器 |
|
L1 |
固定化酶的形态与性质 |
掌握固定化酶的性质,包括活 力和稳定性 |
|
L3 |
理解固定化对酶性质的影响 |
|
L2 |
了解固定化酶的催化特征 |
|
L1 |
影响固定化酶酶促反应的主要 因素 |
掌握影响固定化酶酶促反应的 主要因素 |
能分析影响固定化酶酶促 反应的主要因素 |
L4 |
固定化酶的应用 |
了解固定化酶在不同领域的应 用 |
|
L1 |
蛋白质结晶技术 |
1 |
晶体生长机制 |
掌握晶体的生长机制 |
|
L3 |
结晶条件的筛选和结晶技术 |
掌握影响蛋白质晶体生长的因 素 |
|
L3 |
蛋白质晶体生长方法 |
掌握蛋白质晶体生长的方法 |
能用简单的方法完成蛋白 质晶体的生长 |
L4 |
蛋白质晶体的初步鉴定和挑选 |
理解蛋白质晶体的初步鉴定和 |
|
L2 |
|
|
|
挑选 |
|
|
蛋白质芯片技术 |
2 |
生物芯片的基本概念 |
掌握生物芯片的定义、技术特 点及优势 |
能够说出生物芯片的定义 及组成 |
L3 |
掌握蛋白质芯片的定义、作用及优点 |
能够说出蛋白质芯片的定义 |
L3 |
蛋白质芯片的组成、原理及分类 |
掌握蛋白质芯片的基本构成 |
能够说出蛋白质芯片的基 本构成及原理 |
L3 |
掌握蛋白质芯片的原理 |
|
L3 |
掌握不同点样方式的蛋白质芯片 |
|
L3 |
掌握蛋白质芯片的分类 |
|
L3 |
蛋白质芯片的操作流程 |
掌握蛋白质芯片的操作步骤 |
能够操作蛋白质芯片 |
L3 |
常用的蛋白质芯片 |
了解常用的蛋白质芯片 |
|
L1 |
蛋白质芯片的应用与发展 |
了解蛋白质芯片的应用与未来发展重点 |
|
L1 |
荧光蛋白工程 |
2 |
绿色荧光蛋白 |
了解绿色荧光蛋白的发现 |
|
L1 |
掌握绿色荧光蛋白的结构及特 点 |
能够识别绿色荧光蛋白 |
L4 |
理解绿色荧光蛋白的用途 |
|
L2 |
了解绿色荧光蛋白的应用 |
|
L1 |
理解绿色荧光蛋白的改进 |
|
L2 |
红色荧光蛋白 |
理解红色荧光蛋白的发光原理 |
|
L2 |
了解红色荧光蛋白的应用 |
|
L1 |
蛋白质基因改造的分子设计 |
4 |
蛋白质分子设计的基本理论 |
掌握蛋白质分子设计的层次、 目的、原理 |
|
L3 |
掌握蛋白质分子设计的流程 |
能够写出蛋白质分子设计 |
L3 |
|
|
|
|
的流程 |
|
基于天然蛋白质结构的分子设计 |
掌握蛋白质分子设计的途径与 方法 |
|
L4 |
掌握突变体设计的步骤 |
|
L3 |
理解蛋白质设计中结构-功能 的关系 |
|
L2 |
掌握天然蛋白质的剪裁的方法 及特点 |
|
L3 |
全新蛋白质设计 |
掌握蛋白质结构的从头设计 |
|
L3 |
掌握蛋白质功能的从头设计 |
|
L3 |
计算蛋白质设计 |
了解计算蛋白质设计的途径 |
|
L1 |
蛋白质分子印迹技术 |
2 |
分子印迹技术的基本理论 |
了解分子印迹技术的起源 |
|
L1 |
理解分子印迹技术的定义与原 理 |
|
L2 |
掌握分子印迹技术的过程与作 用 |
|
L3 |
理解分子印迹技术的分类 |
|
L2 |
蛋白质分子印迹方法 |
理解蛋白质分子印迹的各种方 法具体实施过程及要求 |
|
L2 |
蛋白质分子印迹的载体 |
理解蛋白质分子印迹的形式可 变固体载体、形式可变的软质载体及其他类型的载体 |
|
L2 |
了解影响制备蛋白质印迹聚合物的因素 |
|
L1 |
蛋白质分子印迹效率及评价 |
理解蛋白质分子印迹效率的概 念 |
|
L2 |
|
|
|
理解蛋白质分子印迹效率的影 响因素 |
|
L2 |
理解蛋白质分子印迹效率的评 价方法 |
|
L2 |
蛋白质分子印迹技术的应用与 展望 |
了解蛋白质分子印迹技术的应 用及存在的问题 |
|
L1 |
蛋白质生物传感器 |
2 |
生物传感器的基本理论 |
掌握生物传感器的概念、原理、 种类及应用 |
|
L3 |
固定化酶生物传感器 |
掌握固定化酶生物传感器的基 本原理及应用 |
|
L3 |
实时光学蛋白质芯片生物传感 器 |
掌握实时光学蛋白质芯片生物 传感器的基本原理及应用 |
|
L3 |
电化学酶免疫传感器 |
了解电化学酶免疫传感器的基 本原理及应用 |
|
L1 |
适配子生物传感器 |
了解适配子生物传感器的基本 原理 |
|
L1 |
表面等离子共振生物传感器 |
了解SPR 生物传感器的基本原理及应用 |
|
L1 |
纳米技术在促进酶生物传感器方面的应用 |
了解纳米生物材料在生物传感 器中的主要作用 |
|
L1 |
理解常见的纳米材料 |
|
L2 |
注:要求程度填写布鲁姆的教育目标分类法,分别为 L1——知道、L2——领会、L3——应用、L4——分析、L5——评价。
五、 教学内容
1. 绪论
基本内容:蛋白质工程的内涵;蛋白质工程的功能;蛋白质工程的研究内容; 蛋白质工程的产生与发展;蛋白质工程的应用领域
教学重点:广义蛋白质工程的基本概念;狭义蛋白质工程的含义;蛋白工程的功能及研究内容
教学难点:蛋白质工程与基因工程的区别
2. 蛋白质的结构
基本内容:蛋白质的一级结构;蛋白质氨基酸的构成及作用;蛋白质的二级结构;蛋白质各级结构的基本特点;蛋白质的结构域类型;蛋白质初级结构与高级结构的关系;蛋白质结构与功能的关系;Swiss-PDB Viewer 的使用;PDB 在线分析工具的应用
教学重点:蛋白质各级结构的要点;蛋白质结构与功能的关系;Swiss-PDB
Viewer 的使用;PDB 在线分析工具的应用教学难点:蛋白质的二级结构的类型
3. 工业蛋白质种类与功能特性
基本内容:工业蛋白质的定义及种类;工业蛋白质的理化特性;工业蛋白质的生产特性
教学重点:工业蛋白质的水合能力;工业蛋白质的凝胶性和起泡性; 教学难点:工业蛋白质的生产特性
4. 工业蛋白质改性加工方法与利用途径
基本内容:蛋白质改性的原理和目的;蛋白质改性的途径和方法;改性蛋白质的加工方法;改性蛋白质的利用途径
教学重点:蛋白质改性的原理;蛋白质改性的目的;蛋白质改性的方法; 教学难点:改性蛋白质的加工程序与方法
5. 蛋白质抗体酶工程技术
基本内容:抗体酶的产生的原理与方法;抗体酶的多样性;抗体酶的优点; 抗体酶活性部位的修饰;抗体酶的晶体结构;研究抗体酶的新方法;抗体酶的应用。
教学重点:产生抗体酶的原理;定点突变修饰抗体酶教学难点:抗体酶的晶体结构
6. 酶的固定化技术
基本内容:固化的酶的发展史;酶固定化的定义;酶固定化技术的重要性; 固定化酶的优缺点;酶固定化的机制;酶固定化的方法;固定化酶载体材料与反应器;固定化酶的形态与性质;影响固定化酶酶促反应的主要因素。
教学重点:酶固定化的机制;酶固定化的方法;固定化酶载体材料与反应器; 固定化酶的形态与性质;
教学难点:固定化酶载体材料与反应器;
7. 蛋白质结晶技术
基本内容:晶体生长机制;结晶条件的筛选和结晶技术;蛋白质晶体生长的方法;蛋白质晶体的初步鉴定和挑选。
教学重点:蛋白质晶体生长的方法;蛋白质晶体的初步鉴定和挑选。教学难点:晶体生长机制;
8. 蛋白质组织工程
基本内容:天然蛋白基水凝胶形成的原理、作用和影响因素;蛋白基水凝胶的类型;蛋白基水凝胶结构表征;生物功能表面材料;骨组织工程的蛋白质支架材料;不同蛋白质制备组织工程支架;纳米纤维复合支架;
教学重点:天然蛋白基水凝胶形成的原理、作用和影响因素;蛋白基水凝胶的类型;
教学难点:纳米纤维复合支架
9. 蛋白质芯片技术
基本内容:生物芯片;蛋白质芯片;蛋白质的组成、原理及分类;蛋白质芯片的操作流程;常用的蛋白质芯片;抗体芯片;SPR 传感的蛋白质芯片;微流控芯片技术;蛋白质芯片的应用与发展趋势;
教学重点:蛋白质的组成、原理及分类;蛋白质芯片的操作流程; 教学难点:抗体芯片;SPR 传感的蛋白质芯片;微流控芯片技术
10. 荧光蛋白工程
基本内容:绿色荧光蛋白的发光原理;绿色荧光蛋白的用途与作用;绿色荧光蛋白的改进;红色荧光蛋白的发光原理;红色荧光蛋白的光谱多样性;红色荧光蛋白的来源多样性;红色荧光蛋白的改造;绿色荧光蛋白 Halo Tag 技术;荧光蛋白技术的应用;
教学重点:绿色荧光蛋白的发光原理;绿色荧光蛋白的改进;红色荧光蛋白的发光原理;红色荧光蛋白的光谱多样性;红色荧光蛋白的改造;
教学难点:绿色荧光蛋白 Halo Tag 技术;
11. 蛋白质基因改造的分子设计
基本内容:蛋白质分子设计的目的和原理;基于天然蛋白质结构的分子设计; 全新蛋白质设计;计算蛋白质设计;Discovery-Studio 软件操作
教学重点:基于天然蛋白质结构的分子设计;全新蛋白质设计;
Discovery-Studio 软件操作;
教学难点:计算蛋白质设计;
12. 蛋白质分子印迹技术
基本内容:分子印迹技术的原理;分子印迹技术的过程;蛋白质分子印迹的方法;蛋白质分子印迹的载体;蛋白质分子印迹的效率;蛋白质分子印迹技术的应用;
教学重点:分子印迹技术的过程;蛋白质分子印迹的方法;蛋白质分子印迹的载体;
教学难点:蛋白质分子印迹的效率;
13. 蛋白质生物传感器
基本内容:蛋白质生物传感器的概念、原理、种类和应用;固定化酶生物传感器的基本原理;实时光学蛋白质芯片生物传感器的工作原理;电化学酶免疫传感器的原理;适配子生物传感器的筛选原理;表面等离子共振生物传感器的组成、原理;纳米技术在促进酶生物传感器方面的应用;酶在非水相机有机相中的活性与生物传感器发展趋势;
教学重点:蛋白质生物传感器的概念、原理、种类和应用;固定化酶生物传感器的基本原理;实时光学蛋白质芯片生物传感器的工作原理;表面等离子共振生物传感器的组成、原理;纳米技术在促进酶生物传感器方面的应用;
教学难点:适配子生物传感器的筛选原理;表面等离子共振生物传感器的组成、原理;
六、 成绩评定
考核环节 |
权重 |
平时表现 |
作业 |
20 % |
考勤 |
10 % |
实践 |
实验 |
30 % |
期末考试(撰写综述) |
40 % |
合计 |
100% |
注:①表格中的考核环节仅供参考,可自行修改;②各环节评分标准另行制定。
教材及推荐参考书: 教材:
《蛋白质工程》,李维平主编,科学出版社,2013 年普通高等教育“十二五” 规划教材
推荐参考书:
1. 《蛋白质工程》(第二版),汪世华主编,科学出版社,2008. 普通高等教育十一五规划教材
2 . 王培之主编, 蛋白质工程, 哈尔滨: 黑龙江教育出版社,
ISGN7-5316-1186-4,1991 年 12 月第一版。
推荐网站:
http://bbs.bbioo.com/生物秀论坛
《蛋白质工程》实验教学大纲
英文名称: Protein Engineering 课程号:1200061340 课程学分:2 课程属性:课内
课程学时:26 实验学时:10
课程类别:学科专业平台课程课程性质:专业选修课
课程归属单位:制药工程学院适用专业:生物制药专业编制时间:2016 年 8 月
一、 课程的简介(课内实验略)
二、 先修要求(课内实验略)
三、 预期学习成果
通过实验项目 1,使学生了解常见蛋白质浓度测定方法的原理和应用特点,掌握考马斯亮蓝法测定蛋白质浓度的操作过程。
通过实验项目 2,使学生掌握 Lowry 法测定蛋白质浓度的原理及操作过程,了解各种蛋白质浓度测定方法的优缺点,掌握根据样品特点液研究目的选择合适的蛋白质浓度测定方法。
通过实验项目 3,使学生学习溶菌酶粗提液制备的方法和基本原理,掌握离子交换层析介质处理方法和离子交换层析的基本操作,理解如何通过蛋白粗提液中蛋白特性的差异设计蛋白质纯化的技术路线。
通过实验项目 4,使学生掌握酶活测定的过程,理解酶活力单位。
四、 实验项目设置与内容
序 号 |
实验项目名 称 |
实验内容 |
每组 人数 |
实验 性质 |
是否 必修 |
主要仪器名称 |
1 |
考马斯亮蓝法测定蛋白质含量 |
采用考马斯亮蓝的方法检测未知蛋白质溶液中蛋白质的 含量 |
2 |
综合 |
是 |
紫外可见分光光度计 |
2 |
Lowry 法测定蛋白质含量 |
采用Lowry 法检测未知蛋白质样品中 蛋白浓度 |
2 |
综合 |
是 |
紫外可见分光光度计 |
3 |
蛋清溶菌酶的 纯化 |
提取蛋清中溶菌酶 并进行纯化 |
2 |
综合 |
是 |
层析系统 |
4 |
蛋白酶的活性 测定 |
选一种蛋白酶,测定 酶的活性 |
2 |
综合 |
是 |
可见分光光度计 |
注:①实验性质填写演示、验证、设计或综合;
②是否必修填写是或否。
五、 成绩评定和报告
1. 各实验项目的权重分别为:
实验项目名称 |
权重 |
实验项目 1 |
15 % |
实验项目 2 |
15 % |
实验项目 3 |
40 % |
实验项目 4 |
20 % |
合计 |
100 % |
2. 每个实验项目的考核环节
考核环节 |
实验表现 |
实验结果 |
实验报告 |
合计 |
权重 |
25 % |
15 % |
60 % |
100 % |
注:①表格中的考核环节仅供参考,可自行修改;②各环节评分标准另行制定。
六、 指导书及推荐参考书
实验指导书:教师编写推荐参考书:
1 《现代蛋白质实验技术》,刘国琴主编,中国农业大学出版社;
2 《蛋白质分析实验技术指南》,李玉花主编,高等教育出版社; 推荐网站:
http://bbs.bbioo.com/生物秀论坛
九州网页版本科教学日历
(2016 —2017 学年度第一学期)
任课教师:刘丽萍职称:所属院(部):制药工程学院
课程名称(课程号):1200061340 开课班级(学生人数):生物制药 141(47 人)生物制药 142
(46 人)
学分数: 2 总学时: 36 讲授学时:26 实验(实习)学时:10 其它学时:0
节次 |
周次 |
授课内容提要 |
教学形式 |
1 |
1 |
第一章绪论 第一节蛋白质工程概论 第二节蛋白质工程的功能与研究内容 第三节蛋白质工程的历史回顾与应用研究进展第四节蛋白质工程的主要成就 |
多媒体教学 |
2 |
2 |
第二章蛋白质的结构 第一节蛋白质的初级结构 第二节蛋白质的高级结构 |
多媒体教学 |
3 |
3 |
第三章工业蛋白质种类与功能特性第一节概述 第二节工业蛋白质的种类第三节蛋白质的理化特性 第四节工业蛋白质的生产特性与要求 第四章工业蛋白质改性加工方法与利用途径第一节蛋白质改性的原理与目的 第二节蛋白质改性的途径与方法第三节改性的限制因素 第四节改性蛋白质的加工方法 |
多媒体教学 |
4 |
4 |
第十一章蛋白质组织工程 第一节天然蛋白基水凝胶第二节生物功能表面材料 第三节骨组织工程的蛋白质支架材料第四节不同蛋白质制备组织工程支架 第五节纳米材料复合支架第九章蛋白质结晶技术 第一节晶体生长机制 第二节晶体条件的筛选和结晶技术第三节蛋白质晶体生长的方法 第四节蛋白质晶体的初步鉴定和挑选 |
多媒体教学 |
5 |
5 |
第六章蛋白抗体酶工程技术第一节概述 第二节产生抗体酶的原理与方法 第三节用于产生抗体酶的抗体库技术第四节抗体酶活性部位的修饰 第五节抗体酶的晶体结构 第六节抗体酶的研究新方法 第七节抗体酶的应用 |
多媒体教学 |
6 |
6 |
第八章酶的固定化技术 第一节酶的固定化技术概述 |
多媒体教学 |
|
|
第二节酶的固定化机制第三节酶固定化的方法 |
|
7 |
7 |
第八章酶的固定化技术 第四节固定化酶载体材料与反应器第五节固定化酶的形态与性质 第六节影响固定化酶酶促反应的主要因素 第七节固定化酶的应用 |
多媒体教学 |
8 |
8 |
第十二章蛋白质芯片技术第一节概述 第二节蛋白质芯片的组成、原理及分类第三节蛋白质芯片的操作流程 第四节常用的蛋白质芯片 |
多媒体教学自学 |
9 |
9 |
第十二章蛋白质芯片技术 第五节蛋白质芯片的应用与发展趋势第十三章荧光蛋白工程 第一节绿色荧光蛋白第二节红色荧光蛋白 第三节绿色荧光蛋白 Halo Tag 技术 第四节荧光蛋白技术的应用 |
多媒体教学 |
10 |
10 |
第十四章蛋白质基因改造的分子设计第一节概述 第二节基于天然蛋白质结构的分子设计 |
多媒体教学 |
11 |
11 |
第十四章蛋白质基因改造的分子设计第三节全新蛋白质设计 第四节计算蛋白质设计 |
多媒体教学 |
12 |
12 |
第十六章蛋白质分子印迹技术第一节分子印迹技术概述 第二节蛋白质分子印迹方法 第三节蛋白质分子印迹的载体 第四节蛋白质分子印迹效率及其评价 第五节蛋白质分子印迹技术的应用与展望 |
多媒体教学 |
13 |
13 |
第十七章蛋白质生物传感器第一节概述 第二节固定化酶生物传感器 第三节实时光学蛋白质芯片生物传感器第四节电化学酶免疫传感器 第五节适配子生物传感器 第六节表面等离子共振生物传感器 第七节纳米技术在促进酶生物传感器方面的应用 |
多媒体教学 |
14 |
14 |
实验项目 1 和实验项目 2 |
集中指导 |
15 |
15 |
实验项目 3 |
集中指导 |
16 |
16 |
实验项目 4 |
集中指导 |
注:1.凡遇国家法定节假日,需在授课内容提要栏内注明节假日放假(5 月 1 日劳动节、10 月 1 日国庆节、1 月 1 日元旦节)
2. 本表由课程任课教师填写。一式 3 份,一份自用、一份交所在学院(部)存档备查、一份由学院送交教务处审查。
3. 请不要更改表格的格式,以便全校统一。
教研室主任审批(签名) 教学院长(签名)
20 年月日
九州网页版
教案
2016 ~2017 学年第 1 学期
 学院(部、中心) 制药工程学院课 程 名 称 蛋白质工程
学院(部、中心) 制药工程学院课 程 名 称 蛋白质工程
专业、年级、班级 生物制药 2014(141,142) 主 讲 教 师 刘丽萍
教案编写说明
教案又称课时授课计划,是任课教师的教学实施方案。任课教师应根据专业的培养方案,紧扣教学大纲,认真分析教学内容,切合学生实际,提前编写设计好每门课程每个章、节或主题的全部教学活动。教案编写说明如下:
1、教学时数:指完成一个授课题目所用教学时间。理论课通常以学时数为单位(一般 2 学时),而实践课则以学时数,天数或周数为单位。
2、教学课型表示所授课程的类型,请在理论课、实验课、习题课、实习课及其它栏内选择打“√”。
3、题目:标明章、节或主题。
4、依次列出教学的重点和难点。
5、教学过程(含复习旧课、引入新课、组织教学、启发思维等)。将授课的内容按逻辑层次,有序设计编排。本部分不同课程的授课可有自己的特色。
授课教案应根据专业技术领域发展、教学要求变化、学生实际水平,以及教师以往教学的课后小结、批注等进行补充、修改或重写,以保持教学内容的先进性和适用性。请妥善保存各阶段的教案,并配合好学院的教学检查和归档等工作。
九州网页版教案
课时安排:2 学时 |
教学课型 |
:理论课□√ 实验课□ |
习题课□ |
实习课□ |
其它□ |
题目(教学章、节或主题): 第一节 蛋白质工程概论 1.1 蛋白质工程的内涵 1.2 广义蛋白质工程 1.3 狭义蛋白质工程 1.4 蛋白质工程学与其他学科的关系第二节 蛋白质工程的功能与研究内容 2.1 功能 2.2 研究内容 第三节 历史的回顾与应用研究进展 3.1 从多肽开始 3.2 在基因水平操作 3.3 在生化水平扩展 第四节 蛋白质工程的主要成就 4.1 普遍性应用 4.2 产品的多样性 |
第一章绪论 |
|
|
教学重点、难点: 教学重点:广义蛋白质工程;狭义蛋白质工程;蛋白子工程的功能及研究内容; 教学难点:蛋白质工程与基因工程的区别; |
教学方法: 多媒体教学、自学与课堂讨论相结合 |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握蛋白质工程的概念 |
L3 |
作业 |
了解蛋白质工程的功能 |
L2 |
|

了解蛋白质工程的研究内容 |
L2 |
|
了解蛋白质工程的产生与发展 |
L2 |
|
了解蛋白质工程的应用领域 |
L2 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第一章绪论 第一节蛋白质工程概论 讲述本课程的考查方式以及本课程的学习目的 课件展示问题:如果想让某一个生物的性状在另外一个生物的身上表达,常用的方法有哪些? (提示:种内如何实现?种间如何实现?) 学生以小组为单位,讨论、分析、归纳,然后推举几位同学回答,互相补充,教师最后给 予指导:想让一种生物性状在另一种生物中表达,在种内可以通过常规杂交育种的方法来实现, 但要使有生殖隔离的种间生物实现基因交流,则需基因工程技术。但一个新问题出现了,生物 产生的天然蛋白质是在长期进化过程中形成的,它的结构、性能不能完全满足人类生产和生活 的需要,这就需要对现有蛋白质进行改造, 制造出目前从天然蛋白质中找不到的蛋白质。这样人们又开始了新一轮的探索,蛋白质工程便应运而生。从而引出本课程的教学内容《蛋白质工程》。 引导同学们从衣食住行等方面去思考生活中的蛋白质工程技术。在 ppt 中以逐一播放图片的方式进行引导。在学生讨论完之后,开始蛋白质工程概论的讲授。 1.1 蛋白质工程的内涵 1.1.1 蛋白质工程的概念 1.2 广义蛋白质工程 1.2.1 概念 1.2.2 技术、方法 在这里根据教材中提到的细菌视紫红质,先解释其结构特征及工作原理,然后播放细菌视紫红质的结构及工作原理的英文视频。 1.3 狭义蛋白质工程 1.3.1 概念 1.3.2 技术、方法 1.4 蛋白质工程学与其他学科的关系(稍微介绍,略讲) |
1.4.1
工程学
1.4.2 基因工程
1.4.3 酶工程
1.4.4 生物医学工程
1.4.5 微电子工程
第二节蛋白质工程的功能与研究内容
2.1 功能
2.1.1 改变蛋白质活性
2.1.2 提高蛋白质的稳定性
2.1.3 融合蛋白质
2.1.4 研究蛋白质潜在的性能
(1) 新型多肽尿素
(2) 菌视紫红质
(3) 分子复制机
2.1.5 提高蛋白质的应用价值
2.2 研究内容
2.2.1 蛋白质的分离纯化
2.2.2 蛋白质改性研究
2.2.3 蛋白质多肽应用研究
2.2.4 蛋白质固定化研究
2.2.5 蛋白质结构分析、功能设计和预测
2.2.6 蛋白质的光电化学研究第三节历史的回顾与应用研究进展
3.1 从多肽开始
3.2 在基因水平操作(自学)
3.3 在生化水平扩展(自学)
第四节蛋白质工程的主要成就(了解,举例讲述,其余内容由学生自学)
4.1 普遍性应用
4.2 产品的多样性
学习成果的培养:课堂习题,具体见 ppt,布置思考题。
课时安排:2 学时 |
教学课型:理论课□√ 实验课□ |
习题课□ |
实习课□ |
其它□ |
题目(教学章、节或主题): 第一节 蛋白质的初级结构 1.1 蛋白质的一级结构 1.2 蛋白质原子构成与作用 1.3 蛋白质氨基酸构成与作用第二节蛋白质的高级结构 1.1 蛋白质结构的层次性 1.2 蛋白质构象的多样性 1.3 蛋白质的二级结构 |
第二章蛋白质的结构 |

1.4 蛋白质的超二级结构和结构域 1.5 蛋白质的三级结构和四级结构 1.6 蛋白质初级结构与高级结构的关系第三节 蛋白质结构生物学研究进程 3.1 两个黄金时代 3.2 膜蛋白的挑战 3.3 特殊问题 |
教学重点、难点: 教学重点:蛋白质各级结构的要点;蛋白质结构与功能的关系教学难点:蛋白质的二级结构的类型 |
教学方法: 多媒体教学、自学与课堂讨论相结合 |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握蛋白质的一级结构 |
L4 |
作业 |
掌握蛋白质氨基酸的构成及作用 |
L4 |
讨论 |
掌握蛋白质的二级结构 |
L4 |
作业 |
理解蛋白质各级结构的基本特点 |
L3 |
作业 |
熟悉蛋白质结构域类型 |
L3 |
作业 |
了解蛋白质初级结构与高级结构的关系 |
L2 |
|
了解蛋白质结构与功能的关系 |
L2 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第二章蛋白质的结构 第一节蛋白质的初级结构 1.1 蛋白质的原子构成与基本作用 1.1.1 组成蛋白质基本单位 (1)蛋白质的组成元素及特点 |
1.2 蛋白质氨基酸构成与作用
1.2.1 氨基酸的基本内容
(1) 氨基酸结构的通式
(2) 氨基酸分类关系图
(3) 给出两个氨基酸结构表示方式(球棒结构、化学表达式以及简写)
(3)氨基酸的分类(以列表的方式呈现)
A. 疏水性氨基酸或化学性质不活泼的氨基酸
B. 亲水性氨基酸或化学性质活泼的氨基酸
C. 荷电氨基酸或酸性、碱性氨基酸
(3) 其他分类方法(给出其他分类方法下每种所属氨基酸的简写)
(4) 几种特殊的氨基酸(给出几种特殊氨基酸的结构)
1.2.2 肽平面
(1) 肽键(用化学式表示肽键的形成过程,以图为例)
A 概念
B 特征
(2) 肽单位(肽单元)
A 概念
B 特征(用图表示)
1.2.3 平面角
1.2.4 肽链结构特征
1.2 蛋白质一级结构
1.3.1 一级结构的定义
1.3.2 一级结构的稳定因素
1.3.3 一级结构的示意图(展示一些一级结构的图片加深影响)
第二节蛋白质的高级结构
1.1 蛋白质结构的层次性(具体见 ppt 图)
1.2 蛋白质构象的多样性
1.2.1 蛋白质构象的概念
1.3 蛋白质的二级结构
1.3.1 α螺旋
1.3.2
β折叠
1.3.3 回折
(1) β转角
(2) γ转角
1.3.4 无规则卷曲
1.4 蛋白质的超二级结构和结构域
1.4.1 超二级结构的概念
1.4.2 结构域的概念
1.4.3 结构域的类型
1.5 蛋白质的三级结构和四级结构
1.5.1 蛋白质三级结构的概念
1.5.2 蛋白质四级结构的概念
1.6 蛋白质初级结构与高级结构的关系
(1) 初级结构与高级结构的关系
(2) 结构与功能的关系
第三节蛋白质结构生物学研究进程(自学)
3.1 两个黄金时代
3.2 膜蛋白的挑战
学习成果的培养:课堂习题,具体见 ppt。
作业(包括预习和课后讨论内容):
预习:
1. 组成蛋白质的氨基酸有哪些?
2. 氨基酸的分类
名词解释:
肽键;肽单位;蛋白质的构象;结构域;一级结构;二级结构;三级结构;四级结构;
简答题:
1. 组成蛋白质的常见氨基酸有哪些?可以将分成几类?
课时安排:2 学时 |
教学课型:理论课□√ 实验课□ 习题课□ 实习课□ 其它□ |
题目(教学章、节或主题): 第三章工业蛋白质种类与功能特性 第一节 概述 1.1 工业蛋白质的发展史 1.2 工业蛋白质的定义 第二节 工业蛋白质的种类 2.1 植物蛋白质 2.2 动物蛋白质 第三节 蛋白质的理化特性 3.1 溶解性 3.2 水合能力 3.3 乳化性 3.4 起泡性 3.5 黏度 3.6 凝胶性 3.7 组织形成性 3.8 风味结合性 第四节 工业蛋白质的生产特性与要求 4.1 工业蛋白质的生产特性 4.2 特性的形成与决定 4.3 生产上对蛋白质特性的要求 4.4 蛋白质功能特性与结构的关系 第四章工业蛋白质改性加工方法与利用途径 第一节 蛋白质改性的原理与目的 1.1 蛋白质改性的原理 1.2 蛋白质改性的目的 第二节 蛋白质改性的途径与方法 2.1 蛋白质改性的途径 2.2 蛋白质改良的方法 |
第三节 改性的限制因素 3.1 产品安全性 3.2 产品功能特性的变化 3.3 营养损失 3.4 生产费用 3.5 产品感官性质 第四节 改性蛋白质的加工方法 4.1 加工程序 4.2 加工方法 第五节 改性蛋白质的利用途径 5.1 胶黏剂类 5.2 可食性薄膜 5.3 表面活性剂 5.4 可降解材料 5.5 控释体系 5.6 造纸业的湿强剂 5.7 蛋白质纤维和纳米纤维 |
教学重点、难点: 教学重点:工业蛋白质的水合能力;工业蛋白质的凝胶性和起泡性;蛋白质改性的原理;蛋白质改性的目的;蛋白质改性的方法; 教学难点:工业蛋白质的理化特性;改性蛋白质的加工程序与方法 |
教学方法: 多媒体教学、自学与课堂讨论相结合 |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握工业蛋白质的定义及种类 |
L3 |
作业 |
掌握工业蛋白质的理化特性 |
L2 |
作业 |
了解工业蛋白质的生产特性 |
L2 |
讨论 |
掌握工业蛋白质改性的原理及目的 |
L3 |
作业 |

掌握工业蛋白质改性的方法和途径 |
L2 |
作业 |
了解改性蛋白质的加工方法 |
L1 |
|
了解改性蛋白质的利用途径 |
L1 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第三章工业蛋白质种类与功能特性 第一节 概述 1.1 工业蛋白质的发展史 1.2 工业蛋白质的定义第二节 工业蛋白质的种类 2.1 植物蛋白质 2.2 动物蛋白质 第三节 蛋白质的理化特性 3.1 溶解性 3.1.1 溶解性概念 3.1.2 影响蛋白质溶解性的因素 (1) 蛋白质的表面疏水性和表面亲水性 (2) pH (3) 温度 (4) 离子强度和离子种类 (5) 有机溶剂 3.2 水合能力 3.2.1 水合作用的概念 3.2.2 影响水合能力的因素 3.2.3 蛋白质水合能力的测得方法 3.3 乳化性 3.4 起泡性 3.5 黏度 3.6 凝胶性 3.7 组织形成性 3.8 风味结合性 |
第四节 工业蛋白质的生产特性与要求
4.1 工业蛋白质的生产特性
4.2 特性的形成与决定
4.3 生产上对蛋白质特性的要求
4.4 蛋白质功能特性与结构的关系
学习成果的培养:课后习题,具体见 ppt。
第四章工业蛋白质改性加工方法与利用途径
第一节 蛋白质改性的原理与目的
1.1 蛋白质改性的原理
1.2 蛋白质改性的目的
1.2.1 改变原有蛋白质的基本属性(举例讲解)
(1) 改变蛋白质的配体专一性
(2) 改造蛋白酶抑制剂的亲和力和专一性
(3) 改造肽链的结构
1.2.2 增加蛋白质稳定性
1.2.3 提高酶的活性
1.2.4 增强酶的选择性
1.2.5 改变酶的表面特性
1.2.6 保持原有功能缩短肽链第二节 蛋白质改性的途径与方法
2.1 蛋白质改性的途径
2.2 蛋白质改良的方法
2.2.1 物理改性
(1) 利用高频电场
(2) 高压均质
2.2.2 化学改性
(1) 碱处理
(2) 酸处理
(3) 酰化反应
(4) 磷酸化作用
(5)
酰胺化
(6) 硫醇化
(7) 酯化
(8) 糖基化
(9) 去酰胺基
2.2.3 酶法改性
2.2.4 基因工程改性
(1) 引入二硫键增加蛋白质的稳定性
(2) 稳定α螺旋的偶极
(3) 突变甘氨酸或脯氨酸
(4) 分子核心结构改良第三节 改性的限制因素(自学)
3.1 产品安全性
3.2 产品功能特性的变化
3.3 营养损失
3.4 生产费用
3.5 产品感官性质
第四节 改性蛋白质的加工方法(自学)
4.1 加工程序
4.2 加工方法
第五节 改性蛋白质的利用途径(自学)
5.1 胶黏剂类
5.2 可食性薄膜
5.3 表面活性剂
5.4 可降解材料
5.5 控释体系
5.6 造纸业的湿强剂
5.7 蛋白质纤维和纳米纤维
学习成果的培养:课后习题,具体见 ppt。
作业(包括预习和课后讨论内容):
课时安排:2 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 第六章 蛋白抗体酶工程技术 第一节 概述 1.1 抗体的多样性 1.2 抗体酶的产生 1.3 抗体酶的优点 第二节 产生抗体酶的原理与方法 2.1 原理 2.2 方法 第三节 用于产生抗体酶的抗体库技术 3.1 PCR 引物克隆 3.2 生物合成反应法 3.3 直接筛选法 第四节 抗体酶活性部位的修饰 4.1 定点突变法 4.2 化学修饰法 第五节 抗体酶的晶体结构 5.1 抗体酶 1F7 5.2 抗体酶 17E8 5.3 抗体酶 48G7 第六节 抗体酶研究新方法 6.1 半抗原设计方法 6.2 抗体催化的化学转化范围 6.3 挑战与展望 第七节 抗体酶的应用 7.1 抗体酶在有机合成中的应用 7.2 用于阐明化学反应机制的抗体酶 7.3 抗体酶在医疗上的应用 |
教学重点、难点: 教学重点:产生抗体酶的原理;定点突变修饰抗体酶 |

教学难点:抗体酶的晶体结构 |
教学方法: 多媒体教学、自学与课堂讨论相结合 |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握抗体酶的产生的原理与方法 |
L3 |
作业 |
了解抗体酶的多样性 |
L2 |
|
了解抗体酶的优点 |
L2 |
作业 |
知道抗体酶活性部位的修饰 |
L2 |
|
了解抗体酶的晶体结构 |
L1 |
讨论 |
知道抗体酶研究的新方法 |
L2 |
作业 |
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第六章 蛋白抗体酶工程技术 第一节 概述 1.1 抗体的多样性 1.2 抗体酶的产生 1.3 抗体酶的优点 第二节 产生抗体酶的原理与方法 2.1 原理 2.1.1 利用抗体稳定带电过渡态 2.1.2 利用抗体作为熵阱 2.1.3 利用抗体与半抗原的互补性 2.2 方法 2.2.1 多底物类似物法 2.2.2 选择性化学修饰法 (1) 引入巯基法 (2) 引入硒代半胱氨酸法 2.2.3 蛋白质工程法 (1)引入组氨酸 |
(2) 引入金属离子
第三节 用于产生抗体酶的抗体库技术
3.1 PCR 引物克隆
3.1.1 原理
3.1.2 优越性
3.1.3 筛选步骤
3.2 生物合成反应法
3.2.1 原理
3.2.2 筛选步骤
3.3 直接筛选法
第四节 抗体酶活性部位的修饰
4.1 定点突变法
4.1.1 寻找关键残基
4.1.2 诱导突变或引入残基
4.1.3 检测催化作用
4.2 化学修饰法
4.2.1 原则
4.2.2 试剂修饰
4.2.3 酶固定化修饰
第五节 抗体酶的晶体结构(见 ppt 图)
5.1 抗体酶 1F7
5.2 抗体酶 17E8
5.3 抗体酶 48G7
第六节 抗体酶研究新方法(略讲)
6.1 半抗原设计方法
6.2 抗体催化的化学转化范围
6.3 挑战与展望
第七节 抗体酶的应用(自学)
7.1 抗体酶在有机合成中的应用
7.2 用于阐明化学反应机制的抗体酶
7.3 抗体酶在医疗上的应用
课时安排:3 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 第八章 酶的固定化技术 第一节 酶的固定化技术概述 1.1 固定化酶的发展史 1.2 固定化酶发展的动因与过程 1.3 酶固定化的定义 1.4 酶固定化技术的重要性 1.5 固定化酶的优缺点第二节 酶固定化的机制 2.1 酶分子与载体连接的功能基团 2.2 载体的选择 2.3 偶联反应 第三节 酶固定化的方法 3.1 固定化方法分类 3.2 物理固定法 3.3 化学固定法 3.4 各种固定化酶特点的比较 第四节 固定化酶载体材料与反应器 4.1 载体分类 4.2 对载体的要求 4.3 天然载体及改进 4.4 合适的固定化条件 4.5 固定化酶反应器 第五节 固定化酶的形态与性质 5.1 固定化酶的形态 5.2 固定化酶的活力 5.3 固定化酶的稳定性 5.4 固定化对酶性质的影响 5.5 固定化酶的催化特征 第六节 影响固定化酶酶促反应的主要因素 |

第七节 固定化酶的应用 7.1 工业生产上的应用 7.2 医药方面的应用 7.3 化学分析方面的应用 7.4 环境保护方面的应用 7.5 新能源的开发 |
教学重点、难点: 教学重点:酶固定化的机制;酶固定化的方法;固定化酶的形态与性质; 教学难点:固定化酶载体材料与反应器 |
教学方法: |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握酶固定化的机制 |
L3 |
作业 |
掌握酶固定化的方法 |
L3 |
作业 |
掌握酶载体材料与反应器的相关内容 |
L3 |
作业 |
掌握固定化酶的形态与性质 |
L3 |
作业 |
知道影响固定化酶酶促反应的主要因素 |
L2 |
讨论 |
了解固定化酶的应用领域 |
L1 |
讨论 |
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第八章 酶的固定化技术 第一节 酶的固定化技术概述 1.1 固定化酶的发展史(简要讲述固定化酶的发展史) 1.2 固定化酶发展的动因与过程 1.2.1 固定化酶发展的动因 (1) 化学催化剂 (2) 酶催化剂 |
(3) 固定化酶催化剂
(4) 固定化酶感应器
1.3 酶固定化的定义
1.3.1 酶固定化的概念
1.3.2 酶固定化技术的概念
1.3.3 固定化酶的概念
1.4 酶固定化技术的重要性
1.4.1 提高经济效益
1.4.2 促进生产自动化
1.4.3 实现环境保护
1.4.4 使得电化学性能得以开发
1.4.5 推进技术的再开发
1.5 固定化酶的优缺点
1.5.1 固定化酶的优点
(1) 容易将固定化酶和底物、产物分开
(2) 可以在较长时间内进行反复分批反应和装柱连续反应
(3) 大多数情况下,提高酶的稳定性
(4) 酶反应过程能够加以严格控制
(5) 产物溶液中没有酶的残留
(6) 比游离酶更适于进行多酶反应
(7) 增加产物收率,提高产物质量
(8) 酶的使用效率提高,成本降低
1.5.2 固定化酶的缺点
(1) 固定化时,酶活力有损失
(2) 增加生产成本,工厂初始投资较大
(3) 只能用于可溶性底物,适于小分子底物
(4) 不适宜多酶反应,特别是需要辅助因子的反应
(5) 胞内酶必须经过酶的分离过程第二节 酶固定化的机制
2.1 酶分子与载体连接的功能基团
2.2 载体的选择
2.3
偶联反应
2.3.1 重氮法
2.3.2 卤素取代法
2.3.3 巯基-二硫基交换反应第三节 酶固定化的方法
3.1 固定化方法分类
3.1.1 理化分类法
3.1.2 载体分类法
3.2 物理固定法
3.2.1 吸附法
(1) 物理吸附法
(2) 离子吸附法
3.2.2 包埋法
(1) 包埋法的概念
(2) 包埋法的种类
A. 凝胶包埋法
B. 微胶囊包埋法
a) 界面聚合法
b) 液体干燥法
c) 界面沉淀法
d) 脂质体包埋法
C. 纤维包埋法
3.3 化学固定法
3.3.1 共价键结合法
(1) 常用的载体
(2) 影响因素
(3) 优缺点
3.3.2 交联法
(1) 交联法的定义
(2) 交联法的形式
A. 酶直接交联法
B. 酶辅助蛋白交联
C. 吸附交联法
D. 载体交联法
3.3.3 定向固定
3.3.4 多酶共固
3.3.5 磁性高分子法(了解)
3.3.6 新型载体(自学)
3.4 各种固定化酶特点的比较
3.4.1 与载体结合的比较
3.4.2 优缺点比较
第四节 固定化酶载体材料与反应器
4.1 载体分类
(1) 无机高分子载体
(2) 有机载体
(3) 复合载体
(4) 合成载体
(5) 纳米载体
4.2 对载体的要求
4.3 天然载体及改进
4.3.1 壳聚糖改性
4.3.2 纤维素及衍生物
4.3.3 高分子聚合物
4.3.4 凝胶材料
4.3.5 磁性微球
4.3 合适的固定化条件
(1) 反应时间
(2) pH
(3) 温度
(4) 缓冲液
4.4 固定化酶反应器(了解) 第五节 固定化酶的形态与性质
5.1 固定化酶的形态
5.2 固定化酶的活力
5.3 固定化酶的稳定性
5.4 固定化对酶性质的影响
5.5 固定化酶的催化特征
第六节 影响固定化酶酶促反应的主要因素
6.1 固定化酶催化系统的反应过程
6.2 影响因素
6.2.1 分子构象的改变
6.2.2 位阻效应
6.2.3 微扰效应
6.2.4 分配效应
6.2.5 扩散效应
第七节 固定化酶的应用(自学)
7.1 工业生产上的应用
7.2 医药方面的应用
7.3 化学分析方面的应用
7.4 环境保护方面的应用
7.5 新能源的开发
作业(包括预习和课后讨论内容):名词解释:
固定化酶;酶固定化; 简答题:
1. 试述固定化酶的优缺点。
2. 试论述化学方法固定化酶途径。
3. 试论述固定化酶的形态与性质。
4. 固定化酶合适的固定条件有哪些?
5. 固定化酶的催化特征是什么?
6. 固定化酶的稳定性包括哪些?

课时安排:1 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 第九章 蛋白质结晶技术 第一节 晶体生长机制 1.1 结晶推动力 1.2 溶液分相与结晶相图 1.3 聚集与成簇 1.4 成核 1.5 晶体生长 1.6 场的作用 第二节 结晶条件的筛选和结晶技术 2.1 影响蛋白质晶体生长的因素 2.2 蛋白质晶体的形成 第三节 蛋白质晶体生长的方法 第四节 蛋白质晶体的初步鉴定和挑选 |
教学重点、难点: 教学重点:结晶条件的筛选和结晶技术;蛋白质晶体生长的方法;蛋白质晶体的初步鉴定与挑选 教学难点:晶体生长机制 |
教学方法: 多媒体教学与课堂讨论相结合 |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握晶体生长机制 |
L3 |
作业 |
掌握结晶条件的筛选和结晶技术 |
L3 |
作业 |
掌握蛋白质晶体生长的方法 |
L5 |
作业 |
掌握蛋白质晶体的初步鉴定与挑选 |
L5 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织 教学、交流讨论及启发思维等内容) |
第九章 蛋白质结晶技术
第一节 晶体生长机制
1.1 结晶推动力
1.2 溶液分相与结晶相图
1.3 聚集与成簇
1.4 成核
1.5 晶体生长
1.6 场的作用
1.6.1 重力场
1.6.2 外部电场
1.6.3 外部磁场
1.6.4 超声波与激光
第二节 结晶条件的筛选和结晶技术
2.1 影响蛋白质晶体生长的因素
2.1.1 蛋白质的纯度
2.1.2 pH
2.1.3 温度
2.1.4 沉淀剂
2.2 蛋白质晶体的形成
第三节 蛋白质晶体生长的方法
3.1 气相扩散法
3.1.1 悬滴结晶法
3.1.2 坐滴结晶法
3.2 透析法
3.3 分批静置法
3.4 自由界面扩散法
第四节 蛋白质晶体的初步鉴定和挑选
4.1 刮擦法
4.2 脱水法
4.3 染色法
4.4 偏振光法
课时安排:1 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 第十一章 蛋白质组织工程 第一节 天然蛋白基水凝胶 1.1 形成原理、作用与影响因素 1.2 蛋白基水凝胶的类型 1.3 蛋白基水凝胶结构表征第二节 生物功能表面材料 2.1 生物材料表面与蛋白质、细胞之间的关系 2.2 生物表面材料的构筑 2.3 组织工程中生物材料表面的构筑第三节 骨组织工程的蛋白质支架材料 3.1 支架材料的功能与作用 3.2 骨组织工程要素与支架材料条件 3.3 支架材料的种类 3.4 支架的性能评价 第四节 不同蛋白质制备组织工程支架 4.1 羊毛角蛋白作组织工程支架材料 4.2 丝素蛋白作组织工程支架材料 4.3 玉米醇溶蛋白作组织工程支架材料 4.4 三维多孔支架的制备第五节 纳米纤维复合支架 5.1 纳米纤维的生物学效应 5.2 纳米蛋白纤维种类 5.3 纳米纤维支架材料的构建方法 5.4 纳米纤维支架的表面生物功能修饰 5.5 复合支架的制备 5.6 聚乳酸复合支架的力学性能 |
教学重点、难点: 教学重点:天然蛋白基水凝胶形成原理、作用与影响因素;蛋白基水凝胶的类型;生物材料表 |

面与蛋白质、细胞之间的关系;组织工程中生物材料表面的构筑;骨组织工程的蛋白质支架材料的功能与作用;骨组织工程要素与支架材料条件;羊毛角蛋白作组织工程支架材料; 教学难点:纳米纤维复合支架 |
教学方法: 多媒体教学与课堂讨论相结合 |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握天然蛋白基水凝胶的形成原理、作用与影响因素 |
L3 |
作业 |
掌握蛋白基水凝胶的类型 |
L3 |
作业 |
知道生物材料表面与蛋白质、细胞之间的关系 |
L2 |
|
了解组织工程中生物材料表面的构筑 |
L1 |
|
掌握骨组织工程的蛋白质支架材料功能及作用 |
L3 |
作业 |
知道骨组织工程要素与支架材料条件 |
L2 |
|
掌握羊毛角蛋白作组织工程支架材料的优势、提取及制备 |
L3 |
作业 |
掌握纳米纤维支架材料额构建方法 |
L3 |
作业 |
知道纳米纤维支架的表面生物功能修饰 |
L2 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第十一章 蛋白质组织工程 第一节 天然蛋白基水凝胶 1.1 形成原理、作用与影响因素 1.1.1 形成原理 (1) 组织工程的定义 (2) 细胞培养支架的定义 (3) 材料类型 1.1.2 作用 1.1.3 影响因素 1.2 蛋白基水凝胶的类型 |
1.2.1 天然蛋白基水凝胶
(1) 胶原蛋白
(2) 明胶
(3) 丝素蛋白
(4) 纤维蛋白
(5) 弹性蛋白
(6) 大豆蛋白质
(7) 羊毛角蛋白
1.2.2 合成蛋白基水凝胶
(1) 化学合成
(2) 生物合成
A. 分子自组装合成
B. 基因重组合成
1.2 蛋白基水凝胶结构表征(举例说明) 第二节 生物功能表面材料
2.1 生物材料表面与蛋白质、细胞之间的关系
2.1.1 蛋白质在材料表面的吸附
(1) 吸附过程
(2) 吸附驱动力
(3) 吸附影响因素
2.1.2 细胞在材料表面的响应
(1) 响应过程
(2) 响应影响因素
2.2 生物表面材料的构筑(了解)
2.2.1 分子水平上特异识别
2.2.2 表面化学特性与材料生物功能
2.2.3 表面物理特性与生物材料功能
2.3 组织工程中生物材料表面的构筑
2.3.1 引发特异性生物反应的表面
2.3.2 抗非特异性吸附的表面
2.3.3 分子自组装表面
第三节 骨组织工程的蛋白质支架材料
3.1 支架材料的功能与作用
3.1.1 支架材料的功能
3.1.2 支架材料的作用
3.2 骨组织工程要素与支架材料条件
3.2.1 骨组织工程要素
(1) 种子细胞
(2) 支架材料
(3) 生物活性因子
3.2.2 条件要求
(1) 良好的生物相容性
(2) 良好的生物降解性
(3) 具有三维立体、多孔且互通的网隙结构
(4) 可塑性和一定的机械强度
(5) 材料表面微环境的可调控性
(6) 骨传导性和骨诱导性
3.3 支架材料的种类
3.3.1 天然衍生材料
3.3.2 人工合成材料
3.4 支架的性能评价
第四节 不同蛋白质制备组织工程支架
4.1 羊毛角蛋白作组织工程支架材料
4.1.1 羊毛角蛋白作为支架材料的优势
4.1.2 羊毛角蛋白的提取
4.1.3 羊毛角蛋白膜的制备
4.1.4 羊毛角蛋白海绵状物支架的制备及性能
4.2 丝素蛋白作组织工程支架材料(自学)
4.3 玉米醇溶蛋白作组织工程支架材料(自学)
4.4 三维多孔支架的制备(自学) 第五节 纳米纤维复合支架
5.1 纳米纤维的生物学效应
5.1.1 纳米纤维对细胞黏附的作用
5.1.2 纳米纤维对细胞分化的作用
5.1.3 纳米纤维对细胞的功能表达作用
5.2 纳米蛋白纤维种类
5.2.1 胶原
5.2.2 弹性蛋白
5.2.3 层黏连蛋白
5.2.4 纤维蛋白原
5.3 纳米纤维支架材料的构建方法
5.3.1 静电纺丝法
5.3.2 自组装法
5.3.3 相分离法
5.4 纳米纤维支架的表面生物功能修饰
5.4.1 自然吸收
5.4.2 表面共价键结合
5.4.3 大量生物分子整合
5.5 复合支架的制备(举例说明)
5.6 聚乳酸复合支架的力学性能(自学了解)
作业(包括预习和课后讨论内容):名词解释:
组织工程; 简答题:
1. 简述评价细胞培养支架性能的指标。
2. 简述天然蛋白基水凝胶的形成原理。
3. 简述骨组织支架中羊毛角蛋白膜的制备。
4. 简述纳米纤维支架材料的构建方法。
课时安排:3 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 指理论课的一次课的章、节题目,或实践教学单元、任务、项目、课题等名称。 第十二章 蛋白质芯片技术 第一节 概述 1.1 生物芯片 1.2 蛋白质芯片 第二节 蛋白质芯片的组成、原理及分类 2.1 蛋白质芯片的基本构成 2.2 蛋白质芯片的原理 2.3 蛋白质芯片的分类 第三节 蛋白质芯片的操作流程 3.1 蛋白质芯片的操作步骤 3.2 蛋白质芯片的信号检测 3.3 蛋白质芯片的比较 第四节 常用的蛋白质芯片 4.1 抗体芯片 4.2 SPR 传感的蛋白质芯片 4.3 微流控芯片技术 4.4 国内临床上应用芯片系统 第五节 蛋白质芯片的应用与发展趋势 5.1 蛋白质相关理论研究 5.2 医学应用与研究 5.3 蛋白质芯片在食品分析中的应用 5.4 蛋白质芯片在毒理学中的应用 5.5 蛋白质组芯片 5.6 未来的发展趋势 |
教学重点、难点: 教学重点:生物芯片技术的特点及优势;蛋白质芯片技术的特点及优势体现;蛋白质芯片的原 |

理、基本构成;三种生化活性类蛋白质芯片的原理与作用;抗体芯片的原理与操作流程; 教学难点:蛋白质芯片的操作步骤; |
教学方法: |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握生物芯片技术的特点及优势 |
L3 |
作业 |
掌握蛋白质芯片技术的特点及优势体现 |
L3 |
作业 |
掌握蛋白质芯片的原理、基本构成 |
L3 |
作业 |
掌握三种生化活性类蛋白质芯片的原理与作用 |
L3 |
作业 |
掌握蛋白质芯片的操作步骤 |
L3 |
作业 |
知道抗体芯片的原理与操作流程 |
L2 |
|
了解其他蛋白质芯片技术 |
L1 |
|
了解蛋白质芯片技术的发展与应用趋势 |
L1 |
课堂讨论 |
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第十二章 蛋白质芯片技术 第一节 概述 1.1 生物芯片 1.1.1 生物芯片的概念 1.1.2 生物芯片技术的特点 1.1.3 生物芯片技术的优点 (1) 信息的获取量大、效率高 (2) 生产成本低 (3) 所需样本和试剂少 (4) 容易实现自动化分析 1.2 蛋白质芯片 1.2.1 蛋白质芯片的作用 (1)蛋白质相互作用研究 |
(2) 蛋白质-脂质相互作用研究
(3) 酶与其底物相互作用研究
(4) 蛋白质与核酸相互作用研究
(5) 蛋白质组学研究
1.2.2 蛋白质芯片技术的优点
(1) 简化样品的前处理、实用性强
(2) 高通量
(3) 使用简便
(4) 高灵敏度
(5) 高准确度
(6) 微量化
第二节 蛋白质芯片的组成、原理及分类
2.1 蛋白质芯片的基本构成
2.1.1 特殊材料制成的固相载体
2.1.2 特定方式的载体表面
2.1.3 分子反应试剂盒
2.1.4 蛋白质芯片的检测系统
(1) 表面增强激光解析离子化技术
(2) 表面等离子体共振检测技术
(3) 原子力显微镜检测技术
(4) 标记检测技术
2.2 蛋白质芯片的原理(画图说明)
2.3 蛋白质芯片的分类
2.3.1 根据生化活性分类
(1) 蛋白质分析芯片
(2) 蛋白质功能芯片
(3) 反相蛋白质芯片
2.3.2 不同点样方式类芯片
(1) 蛋白质微阵列
(2) 微孔板蛋白质芯片
(3) 三维凝胶块芯片
2.3.3 检测类芯片
第三节 蛋白质芯片的操作流程
3.1 蛋白质芯片的操作步骤(图表说明)
3.1.1 载体的选择及抗体或抗原的固化
3.1.2 抗原或抗体的标记
3.1.3 封闭
3.1.4 探针蛋白的制备
3.1.5 抗原抗体的反应
3.2 蛋白质芯片的信号检测
3.2.1 标记检测
3.2.2 非标记检测
3.3 蛋白质芯片的比较(图表说明) 第四节 常用的蛋白质芯片
4.1 抗体芯片
4.1.1 抗体芯片原理
4.1.2 抗体芯片的分析过程与操作流程
4.1.3 抗体的选择
4.1.4 固相载体
4.1.5 样品的处理
4.1.6 数据分析
4.2 SPR 传感的蛋白质芯片(自学)
4.2.1 SPR 传感原理
4.2.2 SPR 传感的蛋白质芯片操作流程
4.3 微流控芯片技术(自学)
4.4 国内临床上应用芯片系统(了解)
第五节 蛋白质芯片的应用与发展趋势(自学,了解)
5.1 蛋白质相关理论研究
5.2 医学应用与研究
5.3 蛋白质芯片在食品分析中的应用
5.4 蛋白质芯片在毒理学中的应用
5.5 蛋白质组芯片

课时安排:2 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 第十三章 荧光蛋白工程 第一节 绿色荧光蛋白 1.1 概述 1.2 绿色荧光蛋白发光原理 1.3 绿色荧光蛋白的用途与作用 1.4 绿色荧光蛋白的改进第二节 红色荧光蛋白 2.1 红色荧光蛋白发光原理 2.2 红色荧光蛋白的光谱多样性 2.3 红色荧光蛋白来源的多样性 2.4 红色荧光蛋白的改造 第三节 绿色荧光蛋白 HaloTag 技术 3.1 HaloTag 技术原理 3.2 应用与优势 3.3 与其他相关技术比较 第四节 荧光蛋白技术的应用 4.1 绿色荧光蛋白的应用 4.2 红色荧光蛋白的应用 |
教学重点、难点: 教学重点:绿色荧光蛋白的发光原理;绿色荧光蛋白的用途与作用;红色荧光蛋白的发光原理; 红色荧光蛋白的用途与作用; 教学难点:绿色荧光蛋白的 HaloTag 技术 |
教学方法: |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握绿色荧光蛋白的发光原理 |
L3 |
作业 |
知道绿色荧光蛋白的用途与作用 |
L2 |
|

掌握红色荧光蛋白的发光原理 |
L3 |
作业 |
知道红色荧光蛋白的用途与作用 |
L2 |
|
掌握绿色荧光蛋白的 HaloTag 技术 |
L3 |
作业 |
了解绿色荧光蛋白的应用 |
L1 |
|
了解红色荧光蛋白的应用 |
L1 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第十三章 荧光蛋白工程 第一节 绿色荧光蛋白 1.1 概述 1.1.1 绿色荧光蛋白的发现 1.1.2 绿色荧光蛋白的组成(ppt 展示 GFP 的晶体结构) 1.2 绿色荧光蛋白发光原理 1.3 绿色荧光蛋白的用途与作用 1.3.1 用途 (1) GFP 是一种独特的报告基因 (2) 构成融合体 1.3.2 作用 (1) 有助于抗癌药物研发 (2) 骨架和细胞分裂、细胞器动力学和泡囊运输研究 (3) 发育生物学和神经生物研究 1.4 绿色荧光蛋白的改进第二节 红色荧光蛋白 2.1 红色荧光蛋白发光原理(发色团的形成过程示意图) 2.2 红色荧光蛋白的光谱多样性 2.3 红色荧光蛋白来源的多样性 2.4 红色荧光蛋白的改造 第三节 绿色荧光蛋白 HaloTag 技术 3.1 HaloTag 技术原理(图片展示技术原理,具体见 ppt) 3.2 应用与优势(举例说明) |
3.3 与其他相关技术比较
第四节 荧光蛋白技术的应用(了解)
4.1 绿色荧光蛋白的应用
4.1.1 分子标记中的应用
4.1.2 蛋白质相互作用中的应用
4.1.3 作为生物传感器
4.2 红色荧光蛋白的应用
作业(包括预习和课后讨论内容):简答题:
1. 简述绿色荧光蛋白的发光原理。
2. 简述绿色荧光蛋白的用途与作用。
3. 简述红色荧光蛋白的发光原理。
简述绿色荧光蛋白 HaloTag 技术
课时安排:4 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 指理论课的一次课的章、节题目,或实践教学单元、任务、项目、课题等名称。 第十四章 蛋白质基因改造的分子设计 第一节 概述 1.1 发展中的蛋白质设计 1.2 蛋白质设计的目的 1.3 蛋白质设计的原理 第二节 基于天然蛋白质结构的分子设计 2.1 设计前的准备 2.2 蛋白质设计的途径与方法 2.3 蛋白质设计中的结构功能关系 2.4 天然蛋白质的剪裁第三节 全新蛋白质设计 3.1 全新蛋白质设计概述 3.2 蛋白质结构的从头设计 3.3 蛋白质功能的从头设计第四节 计算蛋白质设计 4.1 能量表达 4.2 能量优化 4.3 序列结构专一性 4.4 底物专一性设计 4.5 金属结合位点的设计 |
教学重点、难点: 教学重点:蛋白质设计的原理;蛋白质设计的途径和方法;蛋白质设计中结构与功能的关系;计算蛋白质设计 教学难点:全新蛋白质设计 |
教学方法: 多媒体教学与课堂讨论相结合 |
本次课预期学习成果 |

预期学习成果 |
要求 程度 |
评价方式 |
掌握蛋白质设计的目的和原理 |
L3 |
作业 |
掌握蛋白质突变体设计 |
L3 |
作业 |
掌握蛋白质设计的途径与方法 |
L3 |
作业 |
了解蛋白质设计中结构与功能的关系 |
L2 |
|
知道蛋白质的全新设计 |
L2 |
|
了解计算蛋白质设计 |
L2 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第十四章 蛋白质基因改造的分子设计 第一节 概述 1.1 发展中的蛋白质设计(了解) 1.2 蛋白质设计的目的 1.2.1 目的 1.2.2 循环反复过程 1.3 蛋白质设计的原理 1.3.1 内核假设 1.3.2 密堆积 1.3.3 氢键的最大满足 1.3.4 基团的合理分布 1.3.5 金属配位几何 1.3.6 第二壳层 1.3.7 侧链几何排列 1.3.8 独特的结构 第二节 基于天然蛋白质结构的分子设计 2.1 设计前的准备 2.1.1 蛋白质分子设计的两个层次 (1) 已知立体结构 (2) 未知立体结构 2.1.2 蛋白质分子设计流程(流程框图展示,具体见 ppt) |
2.1.3 设计目标及解决的办法
2.1.4 突变体设计的 5 个步骤
2.1 蛋白质设计的途径与方法
2.2.1 理性进化
2.2.2 非理性进化(举例说明)
2.2 蛋白质设计中的结构功能关系
2.2.1 分析蛋白质的结构特征
2.2.2 通过构象变化分析功能残基
2.2.3 通过单一突变间的加和性分析构象变化
2.2.4 根据结构信息确定残基的突变
2.2.5 利用蛋白质同源性鉴定功能残基
2.2.6 其他实验方法鉴定功能残基
2.3 天然蛋白质的剪裁(了解) 第三节 全新蛋白质设计(了解)
3.1 全新蛋白质设计概述
3.2 蛋白质结构的从头设计
3.3 蛋白质功能的从头设计第四节 计算蛋白质设计
4.1 能量表达
4.2 能量优化
4.3 序列结构专一性
4.4 底物专一性设计
4.5 金属结合位点的设计
作业(包括预习和课后讨论内容):简答题:
1. 蛋白质设计的目的是什么?
2. 蛋白质设计的原理是什么?
3. 简述蛋白质突变体设计的 5 个步骤。
4. 简述蛋白质设计的途径与方法。
5. 简述蛋白质结构的从头设计。
课时安排:2 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 第十六章蛋白质分子印迹技术 第一节分子印迹技术概述 1.1 起源 1.2 定义与原理 1.3 过程与作用 1.4 印迹的分类 第二节蛋白质分子印迹方法 2.1 包埋法 2.2 表面印迹聚合法 2.3 亲和印迹法 2.4 冷冻干燥法 2.5 抗原决定基法 2.6 金属离子介导法 2.7 其他 第三节蛋白质分子印迹的载体 3.1 形式固定的硬质载体 3.2 形式可变的软质载体 3.3 其他含有类似载体的形式 3.4 影响制备蛋白质印迹聚合物的因素第四节蛋白质分子印迹效率及其评价 4.1 蛋白质分子印迹效率的概念 4.2 蛋白质分子印迹效率的影响因素 4.3 蛋白质分子印迹效率的评价 第五节蛋白质分子印迹技术的应用与展望(了解,简单讲述,主要通过自学) 5.1 蛋白质分子印迹技术的应用 5.2 分子印迹技术的新进展和新挑战 5.3 分子印迹存在的问题 |
教学重点、难点: |

教学重点:分子印迹的定义;分子印迹技术的原理、过程与作用;分子印迹技术的分类; 蛋白质分子印迹技术的方法;蛋白质分子印迹技术的载体;蛋白质分子印迹技术的应用和新发展;蛋白质分子印迹技术存在的问题 教学难点:蛋白质分子印迹效率的影响因素及评价 |
教学方法: 多媒体教学与课堂讨论相结合 |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握分子印迹的定义 |
L3 |
作业 |
掌握分子印迹技术的原理 |
L3 |
作业 |
掌握分子印迹技术的过程与作用 |
L3 |
作业 |
掌握分子印迹技术的分类 |
L3 |
作业 |
掌握蛋白质分子印迹技术的方法 |
L3 |
作业 |
掌握蛋白质分子印迹技术的载体 |
L3 |
|
掌握蛋白质分子印迹效率的影响因素及评价 |
L3 |
|
了解蛋白质分子印迹技术的应用 |
L1 |
|
知道蛋白质分子印迹技术存在的问题 |
L2 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织教学、交流讨论及启发思维等内容) 第十六章蛋白质分子印迹技术 第一节分子印迹技术概述 1.1 起源 1.2 定义与原理 1.2.1 定义 1.2.2 原理 1.3 过程与作用 1.3.1 印迹过程 1.3.2 作用 |
1.4 印迹的分类
1.4.1 按作用机制分类
(1) 模板预组装
(2) 模板自组装
1.4.2 按反应机制分类
(1) 共价印迹法
(2) 非共价印迹法
(3) 半共价印迹法
(4) 表面印迹法第二节蛋白质分子印迹方法
2.1 包埋法
2.1.1 包埋法的原理
2.1.2 包埋法的过程
2.1.3 包埋法的应用
2.2 表面印迹聚合法
2.2.1 悬浮聚合法
2.2.2 金属螯合法
2.2.3 牺牲基质法
2.2.4 共价固定模板法
2.3 亲和印迹法
2.4 冷冻干燥法
2.5 抗原决定基法
2.6 金属离子介导法
2.7 其他
第三节蛋白质分子印迹的载体
3.1 形式固定的硬质载体
3.1.1 硅胶作为印迹载体
3.1.2 合成树脂球作印迹载体
3.1.3 膜材料作印迹载体
3.1.4 云母作印迹载体
3.2 形式可变的软质载体
3.3 其他含有类似载体的形式
3.3.1 含有环糊精的印迹体系
3.3.2 含有壳聚糖的印迹体系
3.3.3 电极表面印迹
3.4 影响制备蛋白质印迹聚合物的因素
(1) 母体因素
(2) 热力学因素
(3) 溶解度的要求
(4) 作用环境对识别效果的影响
(5) 氢键的作用
第四节蛋白质分子印迹效率及其评价
4.1 蛋白质分子印迹效率的概念
4.2 蛋白质分子印迹效率的影响因素
(1) 模板分子与功能单体间的作用
(2) 制备方法及聚合物形态
(3) 模板分子的去除
(4) 制备及识别的微环境
4.3 蛋白质分子印迹效率的评价
4.3.1 色谱实验法
4.3.2 分批式的客体键合实验
4.3.3 使用原子力显微镜和表面等离子共振技术第五节蛋白质分子印迹技术的应用与展望(了解)
5.1 蛋白质分子印迹技术的应用
5.1.1 分离纯化
5.1.2 生物传感器敏感材料
5.1.3 化学传感
5.1.4 抗体和受体模拟物
5.1.5 催化和药物载体
5.2 分子印迹技术的新进展和新挑战
5.2.1 在水中的分子印迹技术
5.2.2 功能单体和模板在水中的疏水相互作用

课时安排:2 学时 |
教学课型:理论课□实验课□习题课□实习课□其它□ |
题目(教学章、节或主题): 第十七章 蛋白质生物传感器 第一节 概述 1.1 概念 1.2 原理 1.3 种类 1.4 应用 第二节 固定化酶生物传感器 2.1 基本原理 2.2 固定酶的方法 2.3 各种酶电极 2.4 溶胶凝胶固定法制备的生物传感器第三节 实时光学蛋白质芯片生物传感器 3.1 工作原理 3.2 微流道反应器系统 3.3 量化测量 3.4 应用 第四节 电化学酶免疫传感器 4.1 原理 4.2 电流式酶免疫传感器的制备 4.3 免疫传感器自组装过程中的电化学特性 4.4 免疫传感器的响应特性 4.5 MPO 免疫传感器检测校准曲线的制作第五节 适配子生物传感器 5.1 适配子的概念及其筛选原理 5.2 适配子生物传感器 5.3 适配子的应用与展望 第六节 表面等离子共振生物传感器 6.1 一种新的光学现象 6.2 SPR 生物 |

6.3 SPR 生物传感器的组成、原理与构型 6.4 椭偏光学成像技术 6.5 SPR 生物传感器的应用 第七节 纳米技术在促进酶生物传感器方面的应用 7.1 纳米生物材料在生物传感器中的主要作用 7.2 常见的纳米材料 第八节 酶在非水相及有机相中的活性与生物传感器发展趋势 |
教学重点、难点: 教学重点:蛋白质生物传感器的概念、原理、种类和应用;固定化酶生物传感器的基本原理;实时光学蛋白质芯片生物传感器的工作原理;电化学酶免疫传感器的原理;适配子生物传感器的筛选原理;表面等离子共振生物传感器的组成、原理; 教学难点:适配子生物传感器的筛选原理; |
教学方法: 多媒体教学与课堂讨论相结合 |
本次课预期学习成果 |
预期学习成果 |
要求 程度 |
评价方式 |
掌握生物传感器的基本构成与原理及分类 |
L3 |
作业 |
掌握固定化酶生物传感器的基本原理 |
L3 |
作业 |
知道固定酶的方法 |
L2 |
课堂讨论 |
知道实时光学蛋白质芯片生物传感器的工作原理 |
L2 |
|
了解电化学酶免疫传感器的原理及制备 |
L1 |
|
掌握适配子生物传感器的基本原理及制备 |
L3 |
作业 |
了解适配子生物传感器的应用 |
L1 |
|
了解表面等离子共振生物传感器的组成、原理与构型 |
L1 |
|
知道纳米生物材料在生物传感器中的作用及常见纳米材料 |
L2 |
作业 |
了解酶在非水相及有机相中的活性 |
L1 |
|
教学过程:(应体现本次课堂教学的组织与设计,包含回顾上节内容、引入新课、组织 教学、交流讨论及启发思维等内容) |
第十七章 蛋白质生物传感器
第一节 概述
1.1 概念:生物传感器的概念
1.2 原理:生物传感器的原理
1.3 分类(简单介绍每一类传感器的原理,用图片辅助说明展示各种传感器)
1.3.1 按照感受器采用的生命物质分类
(1) 微生物传感器
(2) 免疫传感器
(3) 组织传感器
(4) 细胞传感器
(5) 酶传感器
(6) DNA 传感器
1.3.2 按照传感器器件检测的原理分类
(1) 热敏生物传感器
(2) 场效应管生物传感器
(3) 压电生物传感器
(4) 光学生物传感器
(5) 声波道生物传感器
(6) 酶电极生物传感器
(7) 介体生物传感器
1.3.3 按照生物敏感物质相互作用的类型分类
(1) 亲和型传感器
(2) 代谢型传感器
1.4 应用(了解,举例说明)
第二节 固定化酶生物传感器(复习固定化酶的相关知识)
2.1 基本原理
2.2 固定酶的方法
2.2.1 电化学固定法
(1) 电聚合高分子膜酶传感器
(2) 有机导电聚合物膜
(3) 包埋法形成聚合物
2.2.2 凝胶-凝胶固定法
(1) 凝胶-凝胶固定法的过程
(2) 凝胶-凝胶固定法的优点
2.2.3 水凝胶法
(1) 多糖类水凝胶包埋法
(2) 低温水凝胶法
2.3 各种酶电极
2.3.1 经典酶电极
2.3.2 介体酶电极
(1) 二茂铁及其衍生物作电子媒介
(2) 有机染料作电子媒介体
(3) 四硫富瓦烯作电子媒介体
2.3.3 直接电化学酶电极
2.4 溶胶凝胶固定法制备的生物传感器
2.4.1 电化学传感器
(1) 葡萄糖传感器
(2) 过氧化氢安培型传感器
(3) 胆固醇传感器
2.4.2 光化学传感器
(1) 葡萄糖氧化酶光学传感器
(2) 荧光变化传感器
(3) 紫外光变化传感器
第三节 实时光学蛋白质芯片生物传感器
3.1 工作原理
3.2 微流道反应器系统
3.2.1 微流道反应器系统的组成
3.2.2 微流道反应器系统的优点
3.3 量化测量
3.4 应用
第四节 电化学酶免疫传感器(了解)
4.1 原理
4.2 电流式酶免疫传感器的制备
4.3 免疫传感器自组装过程中的电化学特性
4.4 免疫传感器的响应特性
4.5 MPO 免疫传感器检测校准曲线的制作第五节 适配子生物传感器(了解)
5.1 适配子的概念及其筛选原理
5.1.1 适配子的基本概念
5.1.2 适配子的特点
5.1.3 适配子筛选技术
(1) SELEX 技术筛选过程
(2) SELEX 技术筛选富集
(3) 核酸适体的特点
A. 高亲和力、严格的识别能力和反应的特异性寡聚单链
B. 与靶序列作用的广泛性
C. 用于诊断试验的普遍性
5.2 适配子生物传感器
5.2.1 适配子电化学生物传感器
(1) 原理
(2) 电极
(3) 捕获分子与检测分子
(4) 标记型与非标记型
(5) 实例
5.2.2 适配子压电生物传感器(了解)
5.2.3 体波式适体传感器(了解)
5.2.4 表面声波适体传感器(了解)
5.2.5 适配子光学生物传感器(了解)
5.2.6 基于纳米金颗粒的适配子生物传感器
(1) 原理
(2) 检测方法
(3) 纳米金颗粒的特性
(4) 实例
5.2.7 多孔硅适配子生物传感器(了解)
5.3 适配子的应用与展望(了解)
第六节 表面等离子共振生物传感器(了解)
6.1 一种新的光学现象
6.2 SPR 生物传感器的产生
6.3 SPR 生物传感器的组成、原理与构型
6.4 椭偏光学成像技术
6.5 SPR 生物传感器的应用
第七节 纳米技术在促进酶生物传感器方面的应用
7.1 纳米生物材料在生物传感器中的主要作用
7.2 常见的纳米材料
7.2.1 纳米颗粒
7.2.2 纳米导线
7.2.3 纳米微管
7.2.4 纳米多孔硅
第八节 酶在非水相及有机相中的活性与生物传感器发展趋势(了解)
作业(包括预习和课后讨论内容):名词解释:
生物传感器;生物敏感膜;电化学生物传感器;纳米颗粒;适配子简答题:
1. 试述生物传感器的基本结构与原理。
2. 简述生物传感器的分类。
3. 简述固定化酶生物传感器的基本原理。
4. 简述不同酶电极的原理及其主要功能。
5. 简述适配子的筛选原理。
《蛋白质工程》教学组织方案
《蛋白质工程》课程的教学中,将蛋白质工程的基本原理、基本技术作为教学重点,将蛋白质工程与基因工程的比较作为教学难点。教学过程中,结合教材中蛋白质分子的结构与功能的关系的基础理论知识,引入前沿科技文献的介绍,引导学生进行探究性学习;利用多媒体教学课件,结合教材中蛋白质工程技术的基本原理,采用观看视频的方式,使学生理解蛋白质工程的实施流程,加深对蛋白质工程原理的理解,以突破教学重点。在介绍蛋白质工程的应用时,通过搜集资料和讨论等方式,并注重本专题与生产生活实际的联系,关注蛋白质工程的最新进展,以加深学生对蛋白质工程基本原理及其应用的理解,提高学生搜集和处理信息、合作学习的能力。
1 课时设置
课程设置的时间是达到良好教学效果的前提。《蛋白质工程》课程主要包括蛋白质工程的基本原理,蛋白质的结构与理化性质,工业蛋白质及其应用,蛋白质组织工程,固定化酶技术,蛋白质结晶,蛋白质分子设计,荧光蛋白,蛋白质芯片,蛋白质分子印迹技术及蛋白质生物传感器章节的内容,其中融合了生物化学、微生物学、仪器分析、分子生物学、生物分离工程原理与技术、生物信息学、发酵工
程原理与技术、生化工程等专业基础课程的知识。因此《蛋白质工程》课程学习式在已经学习了以上课程的基础上;并且该课程的学习不仅仅是对单一知识的掌握,还需要将大量知识综合运用,才能达到真正好的学习效果,因此需要学生具有较好的对知识的驾驭能力,
同时如果学习完该课程后可以立刻进行一些相关实践的训练,对课程知识加以巩固,则效果更好。因此该课程设置的时间是大学三年级上学期,包括 26 个理论学时,10 个实验学时。并且在课程结束后,接着就是CDIO3 的课程实习,此时学生的专业基础课程已经完成,知识实际应用能力较强,能够较好的完成 CDIO3 的实验操作内容,同时巩固课程中所学习的知识。
2 教材选择
教材的选择是达到良好教学效果的保障。和其他课程教材选择范围广的现象相比,蛋白质工程课程可选教材较少,并且该课程前沿性很强,对教材的更新速度要求较高。九州网页版制药工程学院的蛋白质工程课程采用的是李维平主编的案例版《蛋白质工程》(科学出版社,2013 年出版),该教材侧重于实例,内容十分丰富,几乎涵盖了蛋白质工程的所有技术研究领域,对于前沿技术有所涉猎,但是讲解较少,虽然在前沿热点的时效性上有些滞后,但是在教学案例的选取和知识结构的安排上是非常合理的。目前其他高校使用的蛋白质工程教材还包括汪世华教授主编的《蛋白质工程》(科学出版社,2008 年出版),该教材内容较多,理论性强,适合作为本课程的参考教材。除此之外,在课堂上向学生介绍生物谷、转学医学网、小木虫等网站作为学习资料下载,知识补充的途径。
3 教学内容安排
教学内容的合理安排是达到良好教学效果的关键。以指定教材为基础,结合一系列辅助教材及参考文献,对课程内容进行重新优化和
更新,突出重点有效讲解是保证教学质量,体现课程系统性、完整性和合理性的关键。蛋白质工程课程涉及多学科内容,这些内容的学习已经有一定的时间间隔,因此在每次教学之前安排课前预习环节,要求学生在课前对相关章节所涉及其他学科知识进行复习巩固,强化基本概念,在蛋白质工程教学期间简化相关学科理论知识的重复介绍,
强调其中蛋白质工程相关的知识,缩小相关学科理论知识的应用范围, 使教学内容更为精炼,体系更为清晰,有利于学生对整个知识系统的 进一步深入了解,同时兼顾了理论学习和实际应用的平衡。
3.1 教学目标
(1) 知识目标 简述蛋白质工程概念和基本原理,简述蛋白质工程的基本技术内容,举例说出蛋白质工程的应用和发展。
(2) 能力目标通过本课程的学习,学生能够用在线工具或者软件对蛋白质结构进行初步简单的分析;通过对教学案例的讨论,培养学生团结合作、探究的能力;通过搜集蛋白质工程产品在生产生活中的应用例子,提高学生搜集信息、处理信息和语言表达能力。
(3) 情感目标 通过对中心法则的分析,尝试运用逆向思维分析和解决问题;通过了解蛋白质工程的发展及成果,激发学生对于生物学知识的兴趣,开阔学生的视野和思路。
3.2 教学重点及难点
(1) 教学重点 蛋白质工程的基本原理及概念、蛋白质工程的技术原理、蛋白质工程的应用及发展。
(2) 教学难点 蛋白质工程与基因工程的关系
3.3 教学过程
(1) 创设情景,激趣导入
课件展示问题:如果想让某一个生物的性状在另外一个生物的身上表达,常用的方法有哪些? (提示:种内如何实现?种间如何实现?)
学生以小组为单位,讨论、分析、归纳,然后推举几位同学回答, 互相补充,教师最后给予指导:想让一种生物性状在另一种生物中表达,在种内可以通过常规杂交育种的方法来实现,但要使有生殖隔离的种间生物实现基因交流,则需基因工程技术。但一个新问题出现了, 生物产生的天然蛋白质是在长期进化过程中形成的,它的结构、性能不能完全满足人类生产和生活的需要,这就需要对现有蛋白质进行改造,
制造出目前从天然蛋白质中找不到的蛋白质。这样人们又开始了新一轮的探索,蛋白质工程便应运而生。从而引出本课程的教学内容
《蛋白质工程》。
在蛋白质结构及理化性质章节的教学过程中,首先给出不同软件绘制的几个蛋白质的一级、二级、三级及四级结构,引导学生进入蛋白质结构的微观世界,然后引起学生的兴趣,想要了解如何绘制这些美妙的蛋白质结构,在课程中引入在线分析工具及蛋白质结构观测工具的教学。
在工业蛋白质及其应用章节的教学过程中,首先引导学生从衣食住行等方面去思考我们生活当中所应用到的蛋白质以及蛋白质工程
技术,通过解释煮鸡蛋的原理,蛋清加热凝固就是高温导致的蛋白质变性过程,蛋清打发乳化等等,告诉学生这就是最简单的蛋白质工程技术的应用。
在蛋白质结晶技术章节的教学过程中,首先在 ppt 中展示了水晶、盐晶体、蛋白质晶体等晶体,通过美图的图片激发学生了解相关晶体 性质的兴趣,然后进入结晶技术原理、过程、实验操作等内容的教学。
在蛋白质生物传感器的教学过程中,首先请学生拿出自己的手机, 举例说出自己手机当中的传感器的名字以及简单的工作模式,然后向 同学展示老师手机当中安装的心率测量App 的使用,引入生物传感器在手机当中的应用,包括血氧测量以及慢性肾病监测等。之后播放一 个关于慢性肾病监测App 的使用视频,引起学生学习生物传感器的兴趣。
3.2 自主学习,提升能力
课件展示导学提纲,引导学生在阅读教材的过程中,掌握本节内容的单点知识,注重与前后知识的联系,并形成知识网络。
导学提纲: (1)蛋白质工程的历史、概念、基本方法、原理及应用;蛋白质工程的主要知识点梳理:关键技术、主要内容;(2)蛋白质的结构基本组成单位、结构与功能的关系、在线工具及软件分析等。学生阅读、归纳总结,共同讨论,教师适时给予指点并评价,使学生主动获取知识,每个人都参与到学习活动中。
3.3 案例分析,突破重点
案例教学是达到良好教学效果的必由之路。蛋白质工程课程和一
般专业基础课程相比具有特殊性。蛋白质工程中的基本方法在其他课程中均有不同程度涉及:如蛋白质结构预测分析技术在生物信息学及仪器分析中涉及,蛋白质的修饰与克隆表达在分子生物学中涉及,蛋白质纯化在生物分离工程原理与技术中涉及等。而蛋白质工程的核心技术——通过各种手段改造、设计和生产具有特定功能的新蛋白质,
这是一个需要将各学科知识融会贯通,从多方面入手才能解决的问题, 因此在该课程教学过程中穿插大量针对性、应用性强,与社会的需要 紧密结合的实例介绍,通过实例的讲解进一步加强理论知识之间的联 系,才能真正让学生掌握该课程的精髓,提高分析解决实际问题的能 力。
课件展示一系列教学案例,引导学生分析归纳,对提出的问题进行探究,形成自己的观点,完善认知结构,从而突破教学重点。
案例 1 天然胰岛素改造成单体速效胰岛素的过程天然胰岛素制剂在储存中易形成二聚体和六聚体,延缓胰岛素从注射部位进入血液, 从而延缓了其降血糖作用,也增加了抗原性,科学家将胰岛素 B 链由
B28 脯氨酸-B29 赖氨酸改为 B28 赖氨酸-B29 脯氨酸,则可降低其聚合作用,使胰岛素快速起作用,该速效胰岛素已通过临床实验。
问题:对天然蛋白质进行改造,你认为应该直接对蛋白质分子进行操作,还是通过对基因的操作来实现?
学生对问题思考、讨论、回答,教师最后归纳总结:毫无疑问应该从对基因的操作来实现对天然蛋白质改造,主要原因如下:(1)任何一种天然蛋白质都是由基因编码的,改造基因即对蛋白质进行改造,
而且改造过的蛋白质可以遗传下去。如果对蛋白质直接改造,即使改造成功,被改造过的蛋白质分子还是无法遗传的。(2)对基因进行改造比对蛋白质直接改造要容易操作,难度要小得多。
要求学生尝试给出蛋白质工程的概念及相关知识点。蛋白质工程是指通过物理化学与生物化学等技术了解蛋白质的结构与功能,并借助计算机辅助设计、基因定点诱变和重组 DNA 技术改造基因,以定向改造天然蛋白质,甚至创造自然界不存在的蛋白质的技术;前提:了解蛋白质的结构和功能;原理:改造基因(基因修饰或基因合成);目的:定向改造或制造蛋白质。在学生回答问题的过程中,可以看着教材回答,可以讨论,也可以互相争论、辩论,形式不限,教师适时予以点拨。
授课时穿插历史小故事,以提高学生对蛋白质工程的学习兴趣。如在讲授胰岛素的结构的时候,引入关于中国科学家首次合成人工胰岛素但是却没有获得诺贝尔学奖的故事。在每一个章节都会引入诺贝尔学奖获得者的生平事迹的简介,让学生体会多学科的交叉以及科研思维的养成过程。
3.4 归纳比较,攻克难点
课件展示蛋白质工程与基因工程的比较项目表,学生积极思考、讨论、归纳、总结,教师用 ppt 展示学生归纳的知识要点,这样学生在解决问题中加深对基础知识的深层次理解,从而解决本节教学的难点。
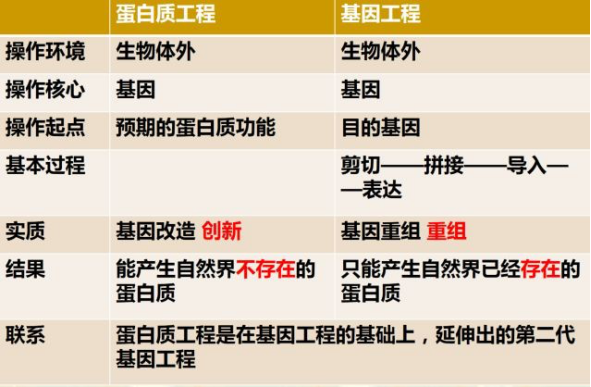
表 1 蛋白质工程与基因工程的比较
3.5 学科动态 引入双语
作为一门综合性学科,蛋白质工程融合了多门学科的发展成果, 想要充分理解教材中相关的知识内容、把握学科的发展动态和研究方向,课本上的知识还远远不够,还需要查阅相关的专业参考文献进行补充,要求学生具备一定的专业英语阅读能力。本课程采取科研文献教学方法,挑选有效协助教学提高,具有代表性的高质量文献,用于课程知识的延展,引导学生关注前沿热点研究内容。除此之外,教师尝试在课堂上对一些专业词汇、知识点进行双语教学,给同学们观看一些国外高校的视频动画,以提高学生的专业外语水平。对于一些难
以理解的知识点或者是一些实验室没有条件和平台进行的实验,在课堂上先进行解释,然后播放相关的英文短片,如表面等离子共振的原理,蛋白质结晶实验技术等,以提高学生对相关知识的感性认识。除了在课堂上播放一小段学术报告视频以外,鼓励学生在网上多听外籍专家的学术报告或者国外名校的生物类公开课,从而拓展学习内容同时提高自己的专业英语能力。
4 开放性实验
开放性实验是达到良好教学效果的有效途径。蛋白质工程课程设立实验教学环节应用与分子生物学、仪器分析和生物分离工程等课程中的教学实验进行区分,突出蛋白质工程课程实验的特点。应提倡蛋白质工程实验教学是进行开放性实验,即学生在熟练掌握各学科基本实验技能,熟悉相关仪器设备的基础上,进行时间、空间、内容和教学方法完全开放的实验,这样就可以为学生的主动学习创造了一个良好的外部环境,激发学生的学习热情。具体来讲,学生只有熟练掌握无菌操作、菌体培养、诱导表达,蛋白纯化,凝胶电泳等实验的基本技能,才可以参加开放性实验。开放性实验首先由教师确定具有实践价值的研究目标,学生通过对课程理论知识的理解并查阅相关文献资料后,与教师进行疑点与难点的交流,并提出大致技术路线,之后经过进一步文献查阅、讨论后确定最终的实验方案,然后学生进行自主实验。通过开放性实验可以将学生的理论学习和实践能力相结合,进一步加深对蛋白质工程课程的理解,加深学生对方法的学习,锻炼学生独立科研工作的能力。
5 考核方式
课程考试是高等学校教学工作的重要环节,在高校创新人才培养中有着重要的作用。课程考试应该要有利于引导学生主动、创造性地学习,是检测和提高学生创新思维和创新能力的重要环节,是评价和改进教学手段,使之有利于培养创新人才。蛋白质工程课程从考试内容方面进行一系列变化,转变考试观念、考核方式多样化、设置创新性题目等。
首先从转变学生的学习和考试观念开始,使学生树立科学的考试观,配合教师的考试模式和方法,使之认识到创新人才培养对于高校教育质量以及今后学生就业的重要性,从自身加强创新意识的培养, 从创新的角度去学习知识,掌握和运用知识。
考核方式多样化,加强过程考核,采用多样化考核方式,调动学生平时学习的积极性,采用多种形式加强对学生平时过程性学习的考核。根据不同阶段的教学要求,灵活运用随堂问答、期末综述撰写以及论文翻译等形式,建立综合化的考评机制,把课程学习过程的考核与课程总体考核、知识的考核与能力的测试、基本技能的掌握与创新等有机结合起来。
设置创新性题目,要求学生能够以蛋白质工程的发展为主线,阐述蛋白质工程理论与技术的进步在生物制药领域的应用,重点考査学生对现代蛋白质工程新理论、新技术的理解,以及能否对前沿科学问题提出自己的创新性解决方案。在作业中增加综合性题目、分析类题
目、设计性题目,答案均为开放式的、非固定化答案,旨在重点考查 学生独立思考、创新思维以及综合运用所学知识解决实际问题的能力。
考试的方式多样化和考试内容的创新导向性
通过期末综述的撰写等总结出学生普遍关心蛋白质工程热点问题,教师可以及时把握学生的兴趣所在,有针对性地加以引导与深化。根据学生的关注度适当调整教学内容,改进教学手段。
6 教学设计理念
以“教师为主导,学生为主体”,教师的“导”立足于学生的“学”,以学法为重心,放手让学生自主探索的学习,主动地参与到知识形成的整个思维过程,力求使学生在积极、愉快的课堂氛围中提高自己的认识水平,从而达到预期的教学效果。